题目内容
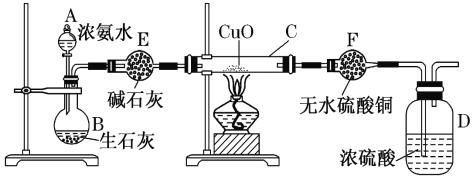
【题目】磁性材料A 是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

(1)A 的化学式为_____。
(2)已知化合物 A 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为 1.518 g·L-1)。该气体分子的电子式为_____,写出该反应的离子方程式:_____。
(3)写出 F→G 反应的化学方程式:_____。
(4)设计实验方案探究溶液 G 中的主要微粒(不考虑 H2O、H+、K+、I-):_____。
【答案】Fe3S4 ![]() Fe3S4+6H+=3Fe2++S+3H2S↑ H2SO3+I2+H2O=H2SO4+2HI 取溶液 G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若又产生白色沉淀,则有 H2SO3。
Fe3S4+6H+=3Fe2++S+3H2S↑ H2SO3+I2+H2O=H2SO4+2HI 取溶液 G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若又产生白色沉淀,则有 H2SO3。
【解析】
C溶液显黄色,加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,B为红棕色固体,可知B为Fe2O3,且n(Fe2O3)=![]() =0.015 mol,n(Fe)=2n(Fe2O3)=0.03 mol,m(Fe)=0.03 mol×56 g/mol=1.68 g,A燃烧生成的无色气体E溶于水得到酸性溶液,加入碘的KI溶液,得到无色溶液G且溶液酸性变强,说明碘单质可氧化E的水溶液,E应为SO2,F为H2SO3,G中含有H2SO4和HI,可能含有未反应的H2SO3,根据原子守恒可知A含有Fe、S元素,且m(S)=2.960 g-1.68 g=1.28 g,n(S)=
=0.015 mol,n(Fe)=2n(Fe2O3)=0.03 mol,m(Fe)=0.03 mol×56 g/mol=1.68 g,A燃烧生成的无色气体E溶于水得到酸性溶液,加入碘的KI溶液,得到无色溶液G且溶液酸性变强,说明碘单质可氧化E的水溶液,E应为SO2,F为H2SO3,G中含有H2SO4和HI,可能含有未反应的H2SO3,根据原子守恒可知A含有Fe、S元素,且m(S)=2.960 g-1.68 g=1.28 g,n(S)=![]() =0.04 mol,可知n(Fe):n(S)=3:4,A的化学式为Fe3S4,以此解答该题。
=0.04 mol,可知n(Fe):n(S)=3:4,A的化学式为Fe3S4,以此解答该题。
根据上述分析可知:A是Fe3S4,B是Fe2O3,C是FeCl3,D为Fe(SCN)3,E是SO2,F为H2SO3,G中含H2SO4、HI及H2SO3等。
(1)由以上分析可知,A组成元素为Fe、S,化学式为Fe3S4;
(2)化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 gL-1),淡黄色不溶物为S,气体的摩尔质量为1.518 g/L×22.4 L/mol=34 g/mol,则气体相对分子质量是34,该气体为H2S气体,H2S分子中S原子最外层有6个电子,其中的2个成单电子与2个H原子的电子形成2对共用电子对,使分子中每个原子都达到稳定结构,故H2S电子式为![]() ,该反应的离子方程式为:Fe3S4+6H+=3Fe2++S+3H2S↑;
,该反应的离子方程式为:Fe3S4+6H+=3Fe2++S+3H2S↑;
(3)F为H2SO3,该物质具有还原性,在溶液中被I2氧化成H2SO4,I2被还原成HI,所以F→G反应的化学方程式为H2SO3+I2+H2O=H2SO4+2HI;
(4)溶液G中的主要微粒(不考虑H2O,H+,K+,I-)为SO42-和H2SO3,可先检验SO42-,后检验有H2SO3,利用BaSO4既不溶于水,也不溶于酸的性质检验,具体操作为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;利用H2SO3的还原性进行检验,过滤后取滤液,向其中滴加H2O2溶液,若又产生白色沉淀,证明含有H2SO3。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) ![]() KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是___;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为____。
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态_____。
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为__;NaAlSi3O8改写成氧化物形式是___。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
1.5 | 2.5 | 3.0 | 3.5 | 4.0 | |
800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
分析数据可以得出,氯化钠熔浸钾长石是__________反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是_______。
(5)Na(l)+KCl(l) ![]() NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为_____。