题目内容
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh= mol/L
(1) ①> ②9.9×10-7 (2)> ;10-8
解析试题分析:混合溶液的pH=6,而0.2 mol/L 的盐酸中c(H+)要大,对水的电离的抑制程度大,所以A>B
由电荷守恒c(Cl-)-c(M+)= c(H+)-c(OH-),10-6-10-8=9.9×10-7 ;(2)碱过量,所以最后的溶液的呈碱性;M Cl的水解平衡常数Kh= Kw/Kb为10-8
考点:水的电离、电荷守恒、弱碱的电离平衡常数与水的电量平衡常数和盐类水解的平衡常数的关系。

 小学教材完全解读系列答案
小学教材完全解读系列答案(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: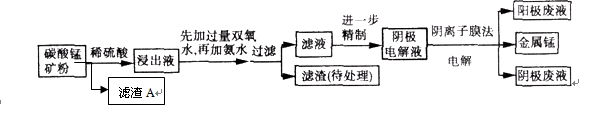
阴离子膜法电解装置如下图所示: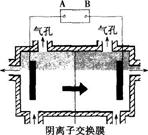
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg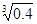 = -0.1 lg
= -0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.2 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
 SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。