题目内容
(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: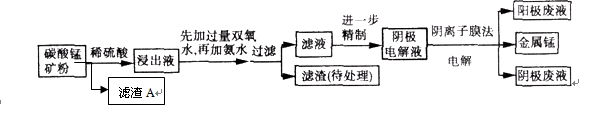
阴离子膜法电解装置如下图所示: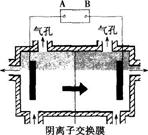
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg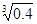 = -0.1 lg
= -0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.2 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
(9分)
(1)MnCO3+2H+=Mn2++CO2↑+H2O
(2)1.9 3.2
(3)Al(OH)3、Fe(OH)3 Mn2+、Mg2+、NH4+
(4)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(5)负极 4OH--4e-=O2↑+2H2O
(6)Mn2+-2e-+2H2O=MnO2+4H+
解析试题分析:(1)硫酸为可溶性强电解质可拆,碳酸锰难溶于水,不可拆,所以反应的离子方程式:MnCO3+2H+=Mn2++CO2↑+H2O
(2)由Ksp (Fe(OH)3) =" 4" ´10–38=c(Fe3+)c3(OH-)可知:c3(OH-)="4" ´10–37,又因为c(H+)="Kw/" c3(OH-),pH="-" lg c(H+)。所以开始生成Fe(OH)3沉淀的pH是1.9。残留在溶液中的离子浓度小于1×10-5 mol?L-1时就认为沉淀完全,同理可得沉淀完全的pH是3.2
(3)加氨水调节溶液的pH等于6,Fe3+ A13+沉淀完全,则“滤渣(待处理)”的成分是Al(OH)3、Fe(OH)3,Fe2+被双氧水完全氧化成Fe3+,滤液中含有的阳离子有H+、Mn2+、Mg2+。
(4)MnO2在酸性条件下被Fe2+还原成了Mn2+,所以在浸出液里锰元素只以Mn2+的形式存在,用离子方程式解释原因为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(5)电解过程中溶液中阴离子向阳极移动,所以电解池中左边为阴极,与电池的负极相连,右边为阳极,与电池的正极相连。阳极失电子,阳极为惰性电极时,溶液的阴离子失电子。S2->I->Br->Cl->OH->含氧酸根>F-,所以阳极的电极反应式为4OH--4e-=O2↑+2H2O。
(6)Mn2+进入阳极区会失电子生成MnO2所以该副反应的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+
考点:原电池和电解池原理

(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: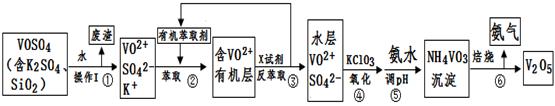
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
【已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39】
(5)该工艺流程中,可以循环利用的物质有 和 。
结合下表回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________________。
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | c(一元酸) | c(NaOH) /mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | 0.1 | pH = x |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | 0.1 | pH = 9 |
(1)上述三种酸中一定属于强酸的是___________;
(2)丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-) = mol/L;
(3)甲组中x的值_____7(填>、<、=);
(4)部分实验反应过程中的pH变化曲线如下图:
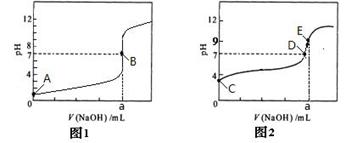
①表示乙组实验的pH变化曲线是________________
②上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
③E点对应离子浓度由大到小的顺序为 。