题目内容
某学生欲配制6.0 mol·L-1的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为________mol·L-1(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为________mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的 18 mol·L-1的浓硫酸 mL,沿玻璃棒倒入上述混合液中。
并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.______________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意________________。
(1)3.0 (2)1 000
(3)295 用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中
(4)偏小
(5)将稀释后的硫酸冷却
解析试题分析:(1)c= =3.0 mol·L-1
=3.0 mol·L-1
(2)要配制6.0 mol·L-1的H2SO4溶液1 000 mL,则要选1 000 mL的容量瓶。
(3)所需的18 mol·L-1的浓硫酸的体积为 =0.295 L=295mL;把溶液转移到容量瓶后,洗涤烧杯和玻璃杯,并把洗涤液注入容量瓶。
=0.295 L=295mL;把溶液转移到容量瓶后,洗涤烧杯和玻璃杯,并把洗涤液注入容量瓶。
(4)若不洗涤会使溶质损失,则配制的溶液浓度会偏小。
(5)必须把稀释后的溶液冷却后,再注入到容量瓶中。
考点:本题考查配制一定物质的量浓度的溶液、化学计算。

 教学练新同步练习系列答案
教学练新同步练习系列答案CO是常见的化学物质,有关其性质和应用的研究如下。
(1)有同学认为CO可以被酸性高锰酸钾溶液氧化为CO2,请你设计实验验证该同学的猜想是否正确。请在下列流程图方框内填上所需药品的名称或化学式,从而补齐你的设计,方框不够可以补,也可以不填满。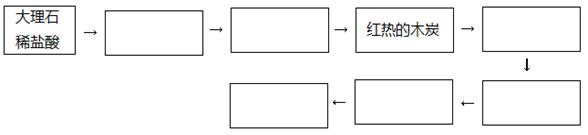
(2)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点—20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃。五羰基合铁的制备原理如下:
Fe(s)+5CO(g) Fe(CO)5(g)
Fe(CO)5(g)
①下列说法正确的是 。
| A.利用上述反应原理可制备高纯铁 |
| B.制备Fe(CO)5应在隔绝空气的条件下进行 |
C.反应Fe(s)+5CO(g) Fe(CO)5(g)的平衡常数表达式为 Fe(CO)5(g)的平衡常数表达式为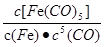 |
| D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存 |
③今将一定量的Fe(CO)5的苯溶液,用紫外线照射片刻。取照射后的溶液完全燃烧,得到30.58gCO2、
5.4gH2O及1.6g红棕色粉末。红棕色粉末的化学式为 ,照射后的溶液中Fe(CO)5和Fe2 (CO)9的物质的量之比为 .
标准状况下,1体积水中能溶解500体积的HCl气体。若向1 L水中通入标准状况下的448LHCl气体,假设气体完全溶解。
(1)若所得溶液密度为1.2 g/cm3,则溶液中含HCl物质的量浓度为 ;
(2)从该溶液中取出10mL浓盐酸溶解于水配制成500mL溶液,配制后的稀溶液中含HCl物质的量浓度为 。
(3)在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有 ;配制过程中,造成浓度偏低的操作可能有_______________(选填下列操作的序号)。
| A.容量瓶蒸馏水洗后未加干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度 |
| D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线 |
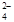 + 2Fe2+ + 4H+
+ 2Fe2+ + 4H+ + 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O