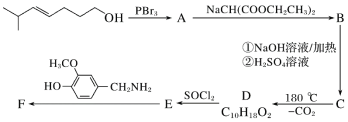
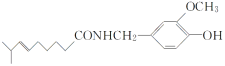题目内容
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是_______,ΔH3=_______kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(ψ)如图所示。

①其中,p1,p2和p3由大到小的顺序是_______,其原因是_______。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)_______vB(N2)(填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_______Pa(分压=总压×物质的量分数,保留一位小数)。
【答案】高温 +247.1 p1>p2>p3 增大压强化学平衡向正反应方向移动,故平衡混合物中氨的体积分数越大压强越大 < 8.3×103或8333.3
【解析】
I.(1)反应自发进行的条件是△H-T△S<0,结合盖斯定律分析解答;
Ⅱ.(2)①由方程式N2+3H22NH3可知,增大压强,平衡正向移动,结合图象中氨的体积分数与压强的关系分析判断;②温度越大,压强越大,反应速率越大;③根据三段式,结合平衡分压=总压×气体物质的量分数计算。
I.(1)水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+205.9kJmol-1,△H>0,△S>0,满足△H-T△S<0,则需要高温;水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+205.9kJmol-1 ①,CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1 ②,二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3 ③,根据盖斯定律,将①+②得到反应③的热化学方程式:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3=(+205.9kJmol-1)+(-41.2kJmol-1)=+247.1kJ/mol,故答案为:高温;+247.1;
II.(2)①由N2+3H22NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为p1>p2>p3,因此压强关系是p1>p2>p3,故答案为:p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;
②温度越大,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,故答案为:<;
③

![]() =0.667,x=0.08,若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)=105Pa×
=0.667,x=0.08,若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)=105Pa×![]() =8.3×103,故答案为:8.3×103。
=8.3×103,故答案为:8.3×103。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(1)设计该实验方案的目的是:探究同周期元素的__________________________。
(2)实验①的现象是 ,反应的化学方程式是 。
【实验二】 为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图。
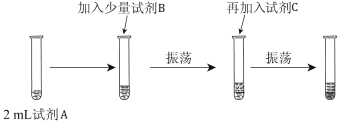
(3)试剂A是 ;试剂B是 ;试剂C是 。
(4)试剂C在实验中所起的作用是 ,加入C振荡、静置后看到的现象是: 。以上反应可以证明Cl2的非金属性_______(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:_______________。
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
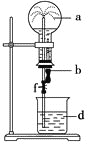
|
| |
A. |
| 水 |
B. |
| 4mol/LNaHSO3溶液 |
C. | Cl2 | 饱和NaCl水溶液 |
D. |
| 1mol/L盐酸 |
A.AB.BC.CD.D