题目内容
18.工业上可用下列装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)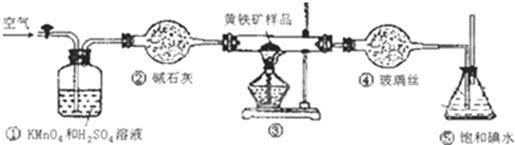
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂B.
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液.
分析 (1)装置③中FeS2在加热条件下与氧气反应生成二氧化硫知氧化铁,根据元素守恒书写化学方程式;
(2)萃取、分液的主要仪器为分液漏斗,根据滴定生成的酸在水溶液中,所以需要取上层水溶液;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,在滴定终点时溶液变为浅红色;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:$\frac{0.020×0.20}{4}$mol×32g/mol×$\frac{300ml}{20ml}$=0.48g,据此计算样品中硫元素的质量分数;
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀.
解答 解:(1)装置③中FeS2在加热条件下与氧气反应生成二氧化硫知氧化铁,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2;
(2)萃取、分液的主要仪器为分液漏斗,因为CCl4密度大于水,所以萃取碘后,有机层在下层,水溶液为上层,则后续滴定生成的酸在水溶液中,所以需要取上层水溶液,故答案为:分液漏斗;上;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率,
故答案为:除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,当滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色,说明滴定已经达到终点,
故答案为:酚酞;滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:$\frac{0.020×0.20}{4}$mol×32g/mol×$\frac{300ml}{20ml}$=0.48g,所以样品中硫元素的质量分数为$\frac{0.48}{2.0}$×100%=24.0%,
故答案为:24.0%;
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀,即氯化钡符合题意,故选:B.
点评 本题考查了利用二氧化硫的性质测定黄铁矿中硫的质量分数,涉及热化学方程式的书写、滴定实验指示剂的选择以及计算等,考查知识点较多,难度中等.

| A. | 可用洁净的铁丝代替铂丝进行焰色反应 | |
| B. | 焰色反应是金属单质的特性 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 氯化钠在火焰上灼烧时火焰呈紫色 |
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,它的熔点一般比纯钛要低 |
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 | |
| B. | 充电时,A为阴极,发生还原反应 | |
| C. | 放电时,B为正极,电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
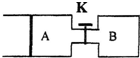 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.下列说法不正确的是( )
| A. | 反应开始时,B容器中化学反应速率比A容器中快 | |
| B. | A容器中X的转化率为20%,且比B容器中X的转化率小 | |
| C. | 打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计) | |
| D. | 打开K达新平衡时,升高B容器的温度,A容器的体积会增大 |
| A. | 标准状况下,1molH2O的体积约为22.4L | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: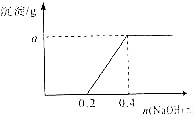 用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:
用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求: