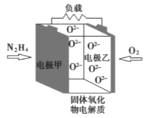
题目内容
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是:
A.标准状况下,22.4 LCC14中所含C—Cl键的数目为4NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C.向密闭容器中充入1 mol N2O4,加热使之充分分解,生成 NO2的分子数为2NA
D.7.8g Na2O2中所含的阴离子数目为0.1NA
【答案】D
【解析】
A. 标准状况下CCl4是液体,22.4 LCCl4的物质的量不是1mol,故A错误;
B. Al3+在溶液中部分水解,在含Al3+总数为NA的AlCl3溶液中,C1-总数大于3NA,故B错误;
C. N2O4![]() 2NO2反应可逆,向密闭容器中充入1 mol N2O4,加热使之充分分解,生成 NO2的分子数小于2NA,故C错误;
2NO2反应可逆,向密闭容器中充入1 mol N2O4,加热使之充分分解,生成 NO2的分子数小于2NA,故C错误;
D. Na2O2中的阴离子是![]() ,7.8g Na2O2中所含的阴离子数目
,7.8g Na2O2中所含的阴离子数目![]() 0.1NA,故D正确;
0.1NA,故D正确;
选D。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A。 | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液 | 紫色石蕊溶液滴入Na2O2中 | CCl4溶液滴入碘水 | Na在空气中放置 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变蓝,随后迅速褪色 | CCl4层由无色变为浅紫色 | 钠表面由银白色变暗 |
A.AB.BC.CD.D
【题目】在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能还有K+、Ag+、Ca2+、Ba2+、NO3-、CO32-、SiO32-、SO42-中的若干种,现取该溶液100mL进行如下实验
已知:H2SiO3为不容水的胶状沉淀,加热时易分解为两种物质
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 生成白色胶状沉淀并放出标况下0.56L气体 |
Ⅱ | 将Ⅰ中产生的混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定存在的离子是______________;一定不存在的离子是____________。
(2)实验Ⅱ中沉淀洗涤、灼烧至恒重,所涉及的化学方程式为____________________;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,求K+的最小浓度_______________。
【题目】下图所示的装置中,烧瓶中充满干燥气体a,然后打开弹簧夹f,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,烧瓶中的液体d呈喷泉喷出,最终几乎充满烧瓶。下列各组不可能出现上述现象的是
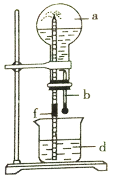
序号 | a(干燥气体) | b(液体)与d(液体) |
A | NO | 水 |
B | CO2 | 4mol·L-1NaOH溶液 |
C | Cl2 | 4mol·L-1NaOH溶液 |
D | NH3 | 1mol·L-1盐酸 |
A.AB.BC.CD.D
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
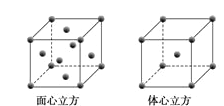
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应