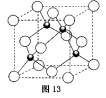
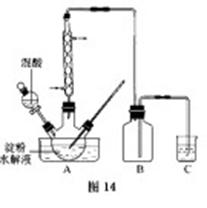
题目内容
NO、NO2均可与NH3反应转化为无害的N2和H2O,现有3.0 L NO、NO2的混合气体,当耗用3.0 L NH3时,可全部转化为N2和H2O,则NO与NO2的体积之比为(体积均为同温、同压下测定)( )A.1∶1 B.1∶2 C.1∶3 D.任意比
解析:存在4NO+5NH3====4N2+6H2O,6NO2+8NH3====7N2+12H2O反应,依据氧化还原反应的计算规则——化合价升高和降低的价态相等,知道NO与NO2的体积之比为1∶1,故A正确。
答案:A

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
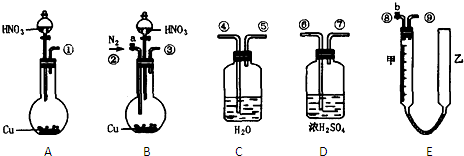
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下: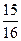 ,则N2的转化率
,则N2的转化率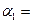 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为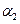 ,则
,则
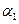 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) 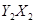 分子中Y原子轨道的杂化类型为
,1mol
分子中Y原子轨道的杂化类型为
,1mol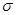 键的数目为 。
键的数目为 。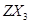 的沸点比化合物
的沸点比化合物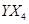 的高,其主要原因是
。
的高,其主要原因是
。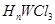 ,反应的化学方程式为
。
,反应的化学方程式为
。