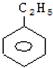
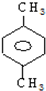
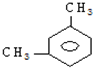
题目内容
10.常温下,pH=6的盐酸稀释100倍后的pH是多少?此时溶液中c(H+)和c(Cl-)的比值是多少?分析 由盐酸溶液pH=6,计算原溶液中c(H+),原溶液中c(Cl-)=c(H+),稀释100倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中氯离子的物质的量不变,计算稀释后溶液中氯离子的物质的量浓度,再计算出此时溶液中c(H+)和c(Cl-)的比值.
解答 解:pH为6的溶液中氢离子浓度是:c(H+)=1×10-6mol/L,氯离子的浓度为:c(Cl-)=c(H+)=1×10-6mol/L;
溶液稀释100倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,p而氯离子浓度为:c(Cl-)=1×10-6mol/L×$\frac{1}{100}$=1×10-8mol/L,
所以稀释后溶液中c(H+)和c(Cl-)的比值是:1×10-7mol/L:1×10-8mol/L=10:1,
答:稀释后的溶液pH为7,c(H+)和c(Cl-)的比值是10:1.
点评 本题考查了溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,确定溶液中氢离子的近似浓度是关键,注意酸碱稀释接近中性应考虑水的电离.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
20.下列叙述正确的是( )
| A. | 电解池将化学能转化为电能 | |
| B. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| C. | 用惰性电极电解饱和NaCl溶液一段时间后,若 通入氯化氢气体,能使电解液恢复到原状态 | |
| D. | 用惰性电极电解Na2SO4溶液,阴阳两极气体产物的物质的量之比为1:2 |
1.已知某有机物A的核磁共振氢谱如图所示,下列说法中,错误的是( )


| A. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3 | |
| C. | 若A的分子式为C3H6O2,则其结构简式为CH3COOCH3 | |
| D. | 若A的化学式为C3H6O2,则其可能的结构有三种 |
18.向KI、Na2S2O3、淀粉三种物质按一定比例组成的混合溶液中快速加入一定量(NH4)2S2O8溶液并开始计时,t s时观察到溶液变蓝色,过程中发生下列反应:
S2O82-+2I-═2SO42-+I2 ①慢
I2+2S2O32-═S4O62-+2I- ②快
下列说法正确的是( )
S2O82-+2I-═2SO42-+I2 ①慢
I2+2S2O32-═S4O62-+2I- ②快
下列说法正确的是( )
| A. | 总反应速率由反应②决定 | |
| B. | 在(NH4)2S2O8消耗完后,溶液显蓝色 | |
| C. | 若能观察到蓝色出现,则起始时,n(Na2S2O3)=n[(NH4)2S2O8] | |
| D. | 0~t s内,v(S2O82-)=v(S2O32-) |
15.下列变化中,需加入氧化剂方能实现的是( )
| A. | MnO4-→Mn2+ | B. | NaCl→AgCl | C. | SO32-→SO42- | D. | Cu2+→Cu |
 )可用于鉴别Ni2+,1mol丁二酮肟含有σ键数目为15NA.
)可用于鉴别Ni2+,1mol丁二酮肟含有σ键数目为15NA. (4)砷与镍形成的一种晶胞结构如图所示,晶胞的边长为a nm,则该晶体的密度为$\frac{292}{{N}_{A}(a×1{0}^{-7})^{3}}$g•cm-3.
(4)砷与镍形成的一种晶胞结构如图所示,晶胞的边长为a nm,则该晶体的密度为$\frac{292}{{N}_{A}(a×1{0}^{-7})^{3}}$g•cm-3.