题目内容
5.镍是一种近似银白色、硬而有延展性并具有铁磁性的金属元素.(1)金属镍是面心立方堆积,则其配位数为12;基态镍原子有2个未成对电子.
(2)硝酸肼镍{Ni[(N2H4)3](NO3)2}是一种配合物,NO3-空间构型是平面三角形(用文字说明);配体N2H4中氮原子杂化轨道类型为sp3;N2H4沸点(113.5℃)比乙烷沸点(-88.6℃)高得多,其主要原因是N2H4分子间可形成氢键,而乙烷分子间不能形成氢键.
(3)丁二酮肟(
 )可用于鉴别Ni2+,1mol丁二酮肟含有σ键数目为15NA.
)可用于鉴别Ni2+,1mol丁二酮肟含有σ键数目为15NA. (4)砷与镍形成的一种晶胞结构如图所示,晶胞的边长为a nm,则该晶体的密度为$\frac{292}{{N}_{A}(a×1{0}^{-7})^{3}}$g•cm-3.
(4)砷与镍形成的一种晶胞结构如图所示,晶胞的边长为a nm,则该晶体的密度为$\frac{292}{{N}_{A}(a×1{0}^{-7})^{3}}$g•cm-3.
分析 (1)晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法确定其配位数;根据原子的外围电子排布分析;
(2)根据价层电子对互斥理论判断NO3-的空间构型和N2H4的杂化类型;分子间含有氢键的沸点较高;
(3)单键中含有一个σ键,双键含有一个σ键和一个π键;
(4)晶胞的边长为a nm=a×10-7cm,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法知,每个平面上Ni原子的配位数是4,三个面共有4×3=12个Ni原子,所以每个Ni原子的配位数是12;Ni原子的外围电子排布式为3d84s2,在3d轨道上有2个未成对电子;
故答案为:12;2;
(2)NO3-中N原子的价层电子对数=3+$\frac{1}{2}$(5+1-2×3)=3,没有孤电子对,则应为平面三角形;N2H4中N原子含有3个成键电子对和1个孤电子对,则价层电子对数为4,所以氮原子杂化轨道类型为sp3;N2H4分子间可形成氢键,而乙烷分子间不能形成氢键,分子间含有氢键的沸点较高,所以N2H4沸点(113.5℃)比乙烷沸点(-88.6℃)高得多;
故答案为:平面三角形;sp3;N2H4分子间可形成氢键,而乙烷分子间不能形成氢键;
(3)已知丁二酮肟的结构式为 ,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;
,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;
故答案为:15NA.
(4)晶胞的边长为a nm=a×10-7cm,则其体积为(a×10-7cm)3,晶胞中As原子数为2,Ni原子数为12×$\frac{1}{4}$+8×$\frac{1}{8}$=4,则晶胞的质量$\frac{2×28+4×59}{{N}_{A}}$=$\frac{292}{{N}_{A}}$g,
所以晶体的密度为ρ=$\frac{m}{V}$=$\frac{\frac{292}{{N}_{A}}g}{(a×1{0}^{-7}cm)^{3}}$=$\frac{292}{{N}_{A}(a×1{0}^{-7})^{3}}$g•cm-3;
故答案为:$\frac{292}{{N}_{A}(a×1{0}^{-7})^{3}}$.
点评 本题考查核外电子排布规律、杂化类型的判断、共价键的类型、晶体类型与性质、晶胞结构与计算等,需要学生具备扎实的知识,题目难度中等.

| A. | 平衡向逆反应方向移动 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变小 | |
| D. | 容器内气体颜色先变深后变浅,最后比原平衡还要深 |
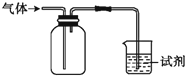 如图装置可用于收集气体并验证其某些化学性质,下列相关的选项正确的是( )
如图装置可用于收集气体并验证其某些化学性质,下列相关的选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NH3 | 酚酞试液 | 溶液变红色 | NH3的水溶液显碱性 |
| B | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2具有漂白性 |
| C | HCl | 硅酸钠溶液 | 生成白色沉淀 | Cl的非金属性比Si强 |
| D | X | KI淀粉溶液 | 溶液变蓝 | X可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2SO4 | B. | (NH4)2SO4 | C. | Fe2(SO4)3 | D. | Al2(SO4)3 |
| A. | 硫酸 | B. | 水 | ||
| C. | 溴水 | D. | 酸性高锰酸钾溶液 |
 效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.
效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.