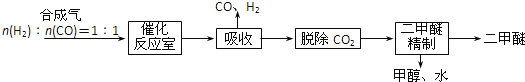
题目内容
【题目】要使溶液中的Ag+、Mg2+、Ba2+三种离子逐一形成沉淀析出,选择的试剂及加入的顺序正确的是( )
A. NaOH―→NaCl―→Na2CO3
B. NaCl―→Na2CO3―→NaOH
C. HCl―→Na2CO3―→NaOH
D. NaCl―→NaOH―→Na2CO3
【答案】D
【解析】A. NaOH能够同时沉淀Ag+、Mg2+,故A错误;B. NaCl能够沉淀Ag+,Na2CO3能够同时沉淀Mg2+、Ba2+,故B错误;C. HCl能够沉淀Ag+,Na2CO3能够同时沉淀Mg2+、Ba2+,故C错误;D. NaCl能够沉淀Ag+,NaOH能够沉淀Mg2+,Na2CO3能够沉淀Ba2+,故D正确;故选D。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___________.
(2)实验室用两种固体制取NH3的反应化学方程式为_____________.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_____________.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为_____________.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变△H_________0(填“>”、“<”或“=”).
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是_____________.图中A点处,NH3的平衡转化率为___________.

(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)2NH3(g),测得甲容器中H2的平衡转化率为40%.
n(N2) | n(H2) | n(NH3) | |
甲 | 1mol | 3mol | 0mol |
乙 | 0.5mol | 1.5mol | 1mol |
丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是_____________(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为_____________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式: ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为 {已知Ksp[Mg(OH)2]=4.0×10-12]}