题目内容
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4—+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
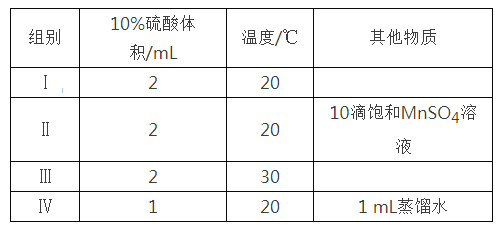
(1)写出该反应的离子方程式______________________,该反应中每生成1molCO2 转移电子数为________ 。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______和________(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验________和_________。
(3)对比实验I和IV,可以研究________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是______________________。
【答案】2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O NA Ⅰ Ⅱ Ⅰ Ⅲ 硫酸的浓度或氢离子浓度 确保溶液总体积不变
【解析】
(1)氧化还原反应可根据得失电子守恒进行配平;
(2)探究反应物浓度、温度、催化剂对反应速率影响,需在其它条件相同的条件下设置对比实验;
(3)对比实验I和IV,根据两个实验中硫酸的量不同分析实验目的;对比实验中,必须确保溶液总体积相同。
(1)反应中MnO4—中Mn由+7价降为+2价,得到电子,发生还原反应,H2C2O4中C由+3价升为+4价,失去电子,发生氧化反应,根据氧化还原反应中得失电子守恒可知,MnO4—与H2C2O4化学计量数之比为2:5,再根据原子守恒和电荷守恒配平方程式,2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,因此该反应中每生成1molCO2 转移电子数为1mol电子,即NA个电子。
(2)由实验目的可以知道,探究反应物浓度、温度、催化剂对反应速率影响,需在相同的条件下对比实验;同浓度溶液,在相同温度下进行反应,Ⅰ无催化剂,,Ⅱ有催化剂,Ⅰ、Ⅱ是研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,则除了温度不同外,其它条件必须完全相同,所以Ⅰ和Ⅲ是探究温度对反应速率的影响;
(3)对比实验I和IV,10%硫酸的体积不同,说明两组实验中的反应物的浓度不同,所以探究的是反应物硫酸(或氢离子)的浓度对化学反应速率的影响;
对比实验I和IV,IV中只加入1mL10%硫酸,与I中加入的溶液总体积不相等,实验IV中需要加入1mL蒸馏水,确保反应溶液的总体积相同。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案






