题目内容
【题目】某化学兴趣小组用Fe2O3与CO反应来制取单质Fe。
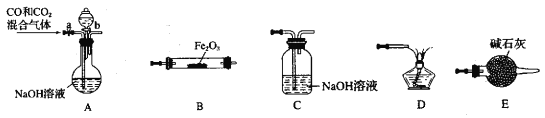
(1)请按气流由左到右的方向连接下列各装置,顺序为A→____→____ →____ →____ 。___________
(2)检查装置A气密性的方法是____________________。
(3)在点燃B处的酒精灯前,应进行的操作是_______。
(4)若用100mL0.1molL的NaOH 溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:________________。
(5)配制100mL 0.1mol/LNaOH 溶液时,下列操作会导致所配溶液浓度偏高的操作是______。A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留。
B.用蒸馏水溶解氢氧化钠固体后,立即转移到容量瓶中,然后洗涤、定容。
C.定容摇匀后,发现液面低于刻度线,又加水到刻度线位置
D.定容时仰视刻度线
E.称量氢氧化钠固体时所用砝码生锈
【答案】 E→B→C→D 将导气管插入水槽中,关闭弹簧夹a和活塞b,微热圆底烧瓶,导管口有气泡产生,撤去热源,导管中形成一段水柱 检查CO的纯度 Ca2++HCO3- + OH- = CaCO3↓+ H2O B E
【解析】(1)A装置的作用是除去CO中混有的二氧化碳,B为Fe2O3与CO反应装置,C的作用为吸收从B中出来的气体混有的二氧化碳,D的作用为燃烧剩余的CO,E的作用为干燥进入B装置的气体.所以各装置顺序为:A→E→B→C→D,故答案为:E→B→C→D;
(2)检查装置A气密性可以将导气管插入水槽中,关闭弹簧夹a和活塞b,微热圆底烧瓶,导管口有气泡产生,撤去热源,导管中形成一段水柱,故答案为:将导气管插入水槽中,关闭弹簧夹a和活塞b,微热圆底烧瓶,导管口有气泡产生,撤去热源,导管中形成一段水柱;
(3)CO为易燃气体,不纯受热会发生爆炸危险,所以在加热前要检验其纯度,故答案为:检验CO气体纯度;
(4)标准状况下,224mLCO2气体的物质的量为![]() =0.01mol,100mL0.1molL的NaOH溶液中含有氢氧化钠的物质的量为0.100L×0.1molL=0.01mol,二者恰好完全反应生成碳酸氢钠,再与0.0100mol氢氧化钙反应,生成碳酸钙沉淀和氢氧化钠,反应的离子方程式为Ca2++HCO3- + OH- = CaCO3↓+ H2O,故答案为:Ca2++HCO3- + OH- = CaCO3↓+ H2O;
=0.01mol,100mL0.1molL的NaOH溶液中含有氢氧化钠的物质的量为0.100L×0.1molL=0.01mol,二者恰好完全反应生成碳酸氢钠,再与0.0100mol氢氧化钙反应,生成碳酸钙沉淀和氢氧化钠,反应的离子方程式为Ca2++HCO3- + OH- = CaCO3↓+ H2O,故答案为:Ca2++HCO3- + OH- = CaCO3↓+ H2O;
(5)A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留,不影响溶质的物质的量和溶液的体积,对结果无影响,错误;B.用蒸馏水溶解氢氧化钠固体后,溶液温度高于常温,立即转移到容量瓶中,然后洗涤、定容,导致溶液体积偏小,浓度偏大,正确;C.定容摇匀后,发现液面低于刻度线,又加水到刻度线位置,导致溶液体积偏大,浓度偏小,错误;D.定容时仰视刻度线,导致溶液体积偏大,浓度偏小,错误;E.称量氢氧化钠固体时所用砝码生锈,导致溶质的物质的量偏大,浓度偏大,正确;故选BE。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】用标准盐酸溶液滴定未知浓度的NaOH溶液,所测数据如下:
滴定 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.20 | 20.22 |
第二次 | 25.00 | 0.56 | 24.54 |
第三次 | 25.00 | 0.42 | 20.40 |
测得NaOH溶液的物质的量浓度为( )
A.0.0853mol/L
B.0.1000mol/L
C.0.0800mol/L
D.0.1250mol/L


