题目内容
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
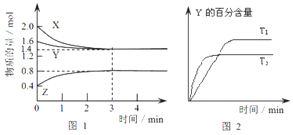
(1)容器中发生的反应可表示为_________________________;
(2)反应进行的前3min内,用X表示的反应速率v(X)=_____________;
(3)保持其他条件不变,升高温度,该反应的化学平衡将________方向移动;(填“正反应”或“逆反应”)
(4)①若X为有色气体,T℃ 时反应达平衡后,将反应容器的容积减少一半,则达到新的平衡后,容器内气体的颜色较原平衡时________;(填“变深、变浅或不变”)
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是_________(填字母代号);
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度
(5)在体积为2L的密闭容器中,充入2mol X和1mol Y进行反应,2min后反应达到平衡,此时平衡混合物中X为0.4mol/L,则Y的转化率为________。
【答案】3X(g)+Y(g)2Z(g) 0.1mol/(Lmin) 正反应 变深 ac 40%
【解析】
(1)根据图示1可知:X、Y是反应物,Z是生成物,根据反应的物质的量的比等于化学计量数之比确定化学计量数,由于最终各种物质都存在,说明该反应是可逆反应,据此书写反应的方程式;
(2)根据v=![]() 计算出反应进行的前3min内,用X表示的反应速率v(X);
计算出反应进行的前3min内,用X表示的反应速率v(X);
(3)由图2可知,温度T2到达平衡需要的时间较短,故T2>T1,温度越高Y的含量降低,升高温度平衡向正反应方向移动;
(4)①根据X浓度的变化分析判断颜色的变化;②根据平衡移动的方向结合题意分析判断;
(5)根据三段式分析计算。
(1)由图1知,X的物质的量减少量为:(2.0-1.4)mol=0.6mol,Y的物质的量减少量为:(1.6-1.4)mol=0.2mol,X、Y为反应物;Z的物质的量增加量为:(0.8-0.4)mol=0.4mol,Z为生成物,同一化学反应同一时间段内,反应物减少的物质的量和生成物增加的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.6mol∶0.2mol∶0.4mol=3∶1∶2,所以反应可表示为:3X(g)+Y(g)2Z(g),故答案为:3X(g)+Y(g)2Z(g);
(2)反应进行的前3min内,用X表示的反应速率为:v(X)= =0.1mol/(Lmin),故答案为:0.1mol/(Lmin);
=0.1mol/(Lmin),故答案为:0.1mol/(Lmin);
(3)“先拐平数值大”,根据图2可知,T2>T1,升高温度后Y的含量减少,即平衡向正反应方向移动,故答案为:正反应;
(4)①若X为有色气体,T℃ 时反应达平衡后,将反应容器的容积减少一半,相当于增大压强,平衡正向移动,但所有物质的浓度均增大,则达到新的平衡后,容器内气体的颜色较原平衡时变深,故答案为:变深;
②a.高温高压,平衡正向移动,气体Y的转化率增大,故a正确;b.加入催化剂,平衡不移动,Y的转化率不变,故b错误;c.减少Z的浓度,平衡正向移动,气体Y的转化率增大,故c正确;d.增加气体Y的浓度,虽然平衡正向移动,但气体Y的转化率减小,故d错误;故答案为:ac;
(5)① 3X(g) + Y(g) 2Z(g)
开始(mol/L): 1 0.5 0
转化(mol/L):0.6 0.2 0.4
平衡(mol/L):0.4 0.3 0.4
所以Y的转化率为![]() ×100%=40%,故答案为:40%;
×100%=40%,故答案为:40%;

【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
k=__________________________。
(3)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:
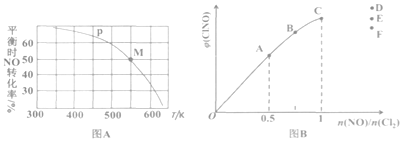
①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在P压强条件下进行,则M点的分压平衡常数KP=________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_______点。
