题目内容
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
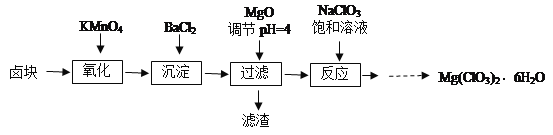
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
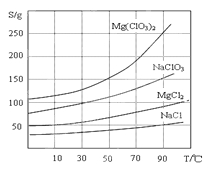
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。
回答下列问题:
(1)调pH时,加入MgO的原因___________。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?____________。
(3)加入NaClO3饱和溶液后发生反应的类型为_____________________________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:蒸发浓缩、①______;②_____;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量4.00 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和30 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液30.00 mL。
①滴定时应用_____________(“酸式”或“碱式”)滴定管。步骤2中发生反应的离子方程式:_____________________________。
②产品中Mg(ClO3)2·6H2O的质量分数为__________。
【答案】 能与H+反应增大pH,不引入新的杂质 静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全 复分解反应 趁热过滤 冷却结晶 酸式 ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O 74.75%
【解析】考查化学工艺流程,(1)根据流程,加入高锰酸钾的目的是把Fe2+氧化成Fe3+,加入BaCl2的目的是除去SO42-,加入MgO的目的是除去Fe3+,原理是加入MgO与H+反应,增大pH,使Fe3+以氢氧化铁形式沉淀出来,同时不引入新的杂质;(2)检验SO42-已完全除去的检验:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;(3)根据实验目的,加入NaClO3饱和溶液,发生复分解反应,生成Mg(ClO3)2;根据溶解度随温度变化曲线,因此采取蒸发浓缩、趁热过滤、冷却结晶、过滤、洗涤;(4)①酸式滴定管盛放酸性溶液和具有强氧化性的溶液,碱式滴定管只能盛放碱性溶液,K2Cr2O7具有强氧化性,因此用酸式滴定管进行滴定;ClO3-具有强氧化性,Fe2+具有还原性,发生氧化还原反应,ClO3-被还原成Cl-,Fe2+氧化成Fe3+,因此离子反应方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;②发生Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,此时消耗的Fe2+是与ClO3-反应剩下的Fe2+,剩下的Fe2+的物质的量为30×10-3×0.1×6mol=1.8×10-2mol,与ClO3-反应的Fe2+物质的量为(30.00×10-3×1.000-1.8×10-2)mol=1.2×10-2mol,因此消耗ClO3-物质的量为2×10-3mol,即Mg(ClO3)2·6H2O物质的量为1×10-2mol,即Mg(ClO3)2·6H2O质量分数为1×10-2×299/4×100%=74.75%。