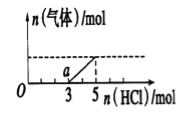
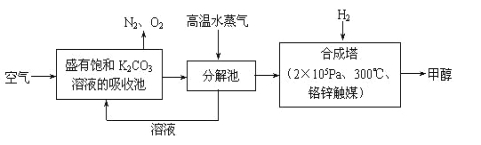
题目内容
【题目】(1)已知一氧化碳与水蒸气的反应为: CO(g) + H2O(g)![]() CO2(g) + H2(g)
CO2(g) + H2(g)
在427 ℃ 时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0. 01 mol/L,则一氧化碳在此反应条件下的转化率为___________。
(2)规律是对经常出现的客观现象的归纳。规律越普遍,适用性或预言性也就越强,然而,任何规律都有其适用范围。
① 某同学在实验中发现,将H2S气体通入CuSO4溶液中,生成了黑色沉淀。请写出反应的化学方程式 ____________。
② 酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中可完全电离。在液氨中,反应CH3COONa + HCl = NaCl + CH3COOH _______(填“能”或“不能”)发生,理由是______________。
【答案】 75% H2S + CuSO4 = CuS↓ + H2SO4 不能 没有难电离的物质生成
【解析】(1) CO(g) + H2O(g)![]() CO2(g) + H2(g)
CO2(g) + H2(g)
起始浓度(mol/L) 0.01 0.01 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 0.01-x 0.01-x x x
根据该温度下的平衡常数可知![]() ,解得x=0.0075,因此一氧化碳在此反应条件下的转化率为75%。
,解得x=0.0075,因此一氧化碳在此反应条件下的转化率为75%。
(2)① 将H2S气体通入CuSO4溶液中,发生复分解反应生成了黑色沉淀CuS和硫酸,反应的化学方程式为H2S+CuSO4=CuS↓+H2SO4。
②由于CH3COOH与HF在液氨中可完全电离,因此该反应CH3COONa+HCl=NaCl+CH3COOH中的生成物均是易电离的,没有难电离的物质生成,所以不能发生。

练习册系列答案
相关题目