题目内容
【题目】X、Y、Z、W四种短周期元素在周期表中的位置关系如右图所示,其中Z元素原子的最外层电子数是其电子层数的2倍。
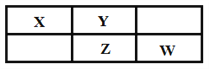
请回答下列问题:
(1)元素Z位于周期表中第_______周期,________族;
(2)这些元素的最高价氧化物对应的水化物中,水溶液酸性最强的是_______(写化学式);
(3)Y和Z组成的化合物的化学式为_______;
(4)W的单质和过量的X的氢化物可发生氧化还原反应,所得两种产物的电子式分别为____________、___________;
(5)W的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol 电子转移时,共产生9 mol 气体,写出该反应的化学方程式___________。
【答案】 三 VIA HClO4 SO2 SO3 ![]()
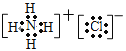 4HClO4 (浓) == 2Cl2↑ + 7O2↑+ 2H2O
4HClO4 (浓) == 2Cl2↑ + 7O2↑+ 2H2O
【解析】X、Y、Z、W四种短周期元素在周期表中的位置关系如图所示,其中Z元素原子的最外层电子数是其电子层数的2倍,Z应该位于第三周期,因此Z是S,结合元素在周期表中的相对位置可知X是N,Y是O,W是Cl,据此解答。
(1)根据以上分析可知元素Z是S,原子序数是16,位于周期表中第三周期第VIA族;(2)非金属性越强,最高价含氧酸的酸性越强,所以这些元素的最高价氧化物对应的水化物中,水溶液酸性最强的是高氯酸,化学式为HClO4;(3)Y和Z组成的化合物可以是二氧化硫或三氧化硫,化学式为SO2、SO3;(4)氯气具有强氧化性,和氨气反应生成氯化氢和氮气,如果氨气过量,则又生成氯化铵。所以所得两种产物分别是氮气和氯化铵,电子式分别为![]() 、
、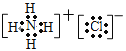 ;(5)W的最高价氧化物对应的水化物的浓溶液高氯酸不稳定,受热可分解,产物之一是黄绿色气体,该气体是氯气,当有28mol电子转移时生成氯气是2mol,因此另一种气体是7mol,根据化合价升降可判断该气体是氧气,则该反应的化学方程式为4HClO4(浓)=2Cl2↑+7O2↑+2H2O。
;(5)W的最高价氧化物对应的水化物的浓溶液高氯酸不稳定,受热可分解,产物之一是黄绿色气体,该气体是氯气,当有28mol电子转移时生成氯气是2mol,因此另一种气体是7mol,根据化合价升降可判断该气体是氧气,则该反应的化学方程式为4HClO4(浓)=2Cl2↑+7O2↑+2H2O。