题目内容
【题目】(10分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。

(1)W位于元素周期表中第 周期第 族画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。
【答案】(10分)(1)三、ⅣA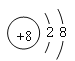 (各1分)
(各1分)
(2)HCl HF (各1分)
(3)Na (1分)Na与冷水反应剧烈,而Mg与冷水反应缓慢(其他答案合理也可)(2分)
(4)NaOH+HClO4=NaClO4+H2O (2分)
【解析】X的一种核素的质量数为18,中子数为10,则X是氧元素。W的单质是一种常见的半导体材料,所以W是硅。根据原子半径大小顺序可知,Y、W、Z属于第三周期,则Y是钠,Z是氯元素。
(1)氧离子的最外层电子数是8个,所以结构示意图为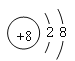 。
。
(2)非金属性越强,相应氢化物的稳定性越强。氯元素的非金属性强于溴元素的,所以氯化氢的稳定性强于溴化氢的。氟化氢分子中还原氢键,所以沸点高于氯化氢的。
(3)同周期自左向右金属性逐渐增强,所以钠的金属性强于镁的。比较金属性强弱可以用金属单质和水反应的剧烈程度来检验。Na与冷水反应剧烈,而Mg与冷水反应缓慢,所以钠强于镁。
(4)氢氧化钠和高氯酸反应的方程式为NaOH+HClO4=NaClO4+H2O。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周
期序数与族序数相等,请回答下列问题:
Q | R | ||
T | W |
(1)T的原子结构示意图为____________
(2)元素原子的得电子能力为Q____W(填“>”或“<”)。
(3)W的单质与其最高价氧化物对应的水化物浓溶液共热能发生反应,生成两种物质,其中一种是具有漂白性的气体,反应的化学方程式为
________________________________________________________________________
(4)原子序数比R多1的元素的一种氢化物在二氧化锰催化作用下易分解为它的另一种氢化物,此分解反应的化学方程式是
________________________________________________________________________
(5)将12 g Q单质在足量的氧气中燃烧,所得气体通入1 L 1.5 mol·L-1NaOH溶液中,完全吸收后,溶液中大量存在的离子有______________。