题目内容
15.下列事实能说明甲酸(HCOOH)属于弱酸的是( )①1mol•L-1 HCOOH溶液的pH=2
②甲酸能与水以任意比互溶
③20mL 1mol•L-1HCOOH与20mL 1mol•L-1NaOH恰好中和
④HCOONa溶液的pH>7.
| A. | ①② | B. | ② | C. | ③④ | D. | ①④ |
分析 ①弱电解质部分电离,强电解质完全电离;
②酸的强弱与水溶性无关;
③20mL 1mol/LHCOOH与20mL 1mol/LNaOH恰好中和,强酸和氢氧化钠也是等物质的量恰好反应;
④强碱弱酸盐水解显碱性.
解答 解:①1mol•L-1 HCOOH若为强酸,完全电离氢离子浓度为1mol•L-1,pH值0,而实际pH为2,所以不能完全电离,为弱酸,故①选;
②酸的强弱与水溶性无关,故②不选;
③20mL 1mol/LHCOOH与20mL 1mol/LNaOH恰好中和,强酸和氢氧化钠也是等物质的量恰好反应,不能通过此判断酸的强弱,故③不选;
④HCOONa溶液的pH>7,说明甲酸钠存在水解,为强碱弱酸盐,可以证明甲酸为弱酸,故④选;
故选:D.
点评 本题考查弱电解质的实验方法设计,熟悉弱酸的性质及弱酸强碱盐的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
5.下列分子的电子式书写正确的是( )
| A. | 氨 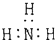 | B. | 四氯化碳 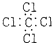 | C. | 氮 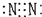 | D. | 二氧化碳 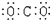 |
6.据报道,${\;}_{67}^{166}$Ho可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
20.已知 和
和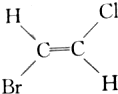 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
 和
和 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
3.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为:Zn+2 OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-,总反应式为Ag2O+Zn=ZnO+2Ag,根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 在使用过程中,电子由Ag2O经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn极发生还原反应,Ag2O极发生氧化反应 |
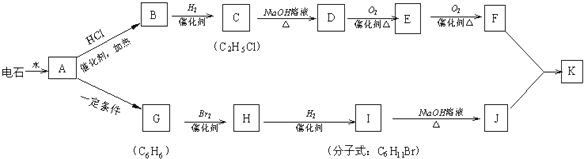
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.