题目内容
【题目】合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
(1)醋酸二胺合铜(I)可以除去原料气中的CO.Cu+基态核外电子排布式为 , 生成的CH3COO[Cu(NH3)3CO]中与Cu+形成配离子的配体为(填化学式).
(2)NH4NO3中N原子杂化轨道类型为 , 与NO3﹣互为等电子体的分子为(填化学式,举一例).
(3)1mol CO(NH2)2H2O2(过氧化尿素)中含有σ键的数目为 .
(4)钉(Ru)系催化剂是目前合成氨最先进的催化剂,一种钌的化合物晶胞结构如图所示,有关该晶体的说法正确的是(填字母).
a.晶胞中存在“RuO62﹣”正八面体结构
b.与每个Ba2+紧邻的O2﹣有12个
c.与每个O2﹣紧邻的Ru4+有6个
d.晶体的化学式为BaRuO3 . 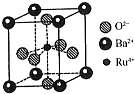
【答案】
(1)1s22s22p63s23p63d10或[Ar]3d10;CO和NH3
(2)sp3、sp2;SO3
(3)10NA
(4)abd
【解析】解:(1)铜原子的核外电子排布为1s22s22p63s23p63d104s1 故一价铜离子的核外电子排布为1s22s22p63s23p63d10或[Ar]3d10;配合物中提供孤电子对的微粒为配体,则CH3COO[Cu(NH3)3CO]中配体为CO和NH3;所以答案是:1s22s22p63s23p63d10或[Ar]3d10;CO和NH3;(2)NH4NO3中铵根离子中N原子的价层电子对数=4+ ![]() (5﹣1+4×1)=4,则杂化类型为sp3 , NO3﹣中N原子的价层电子对数=3+
(5﹣1+4×1)=4,则杂化类型为sp3 , NO3﹣中N原子的价层电子对数=3+ ![]() (5+1﹣3×2)=3,则杂化类型为sp2 , NO3﹣中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3﹣是等电子体;
(5+1﹣3×2)=3,则杂化类型为sp2 , NO3﹣中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3﹣是等电子体;
所以答案是:sp3、sp2;SO3;(3)CO(NH2)2H2O2中含有一个C=O,2个C﹣N,4个N﹣H,1个O﹣O,2个O﹣H,单键中含有一个σ键,双键中含有一个σ键和一个π键,所以1mol CO(NH2)2H2O2(过氧化尿素)中含有σ键的数目为10NA;
所以答案是:10NA;(4)a.六个面心上的O2﹣与中心的Ru4+形成正八面体结构,所以晶胞中存在“RuO62﹣”正八面体结构,故a正确;
b.根据晶胞结构图可知,与Ba2+紧邻的O2﹣分布在与钡离子相连的面的面心上,Ba2+与相紧邻O2﹣有3×8× ![]() =12个,故b正确;
=12个,故b正确;
c.由图可知,Ru4+在晶胞中心,O2﹣在晶胞面心上,与每个O2﹣紧邻的Ru4+有2个,故c错误;
d.晶胞中Ba2+数目为8× ![]() =1,Ru4+的数目为1,O2﹣数目为6×
=1,Ru4+的数目为1,O2﹣数目为6× ![]() =3,所以晶胞的化学式为BaRuO3 , 故d正确;
=3,所以晶胞的化学式为BaRuO3 , 故d正确;
所以答案是:abd.
