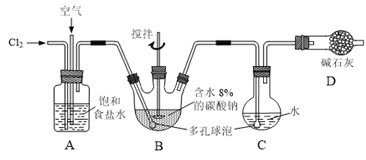
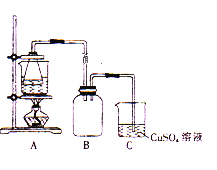
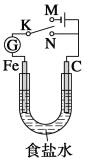
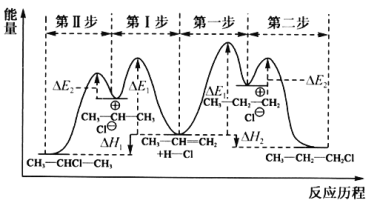
题目内容
【题目】在 2019 年第十届国际二次电池展中,一种以 Fe[Fe(CN)6]为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是
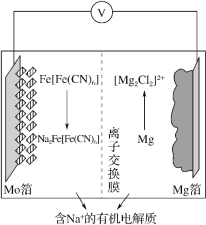
A.充电时,阴极反应式为 Fe[Fe(CN)6 ]+2Na++2e- =Na2Fe[Fe(CN)6 ]
B.充电时,Mg 箔接电源的正极
C.放电时,Na+通过离子交换膜从右室移向左室
D.放电时,外电路中通过 0.4mol 电子时,负极质量变化为 9.2g
【答案】C
【解析】
放电过程中Mg转化为[Mg2Cl2]2+,发生氧化反应,所以Mg箔为电池的负极,则Mo箔为电池的正极。
A.放电时,Mg箔为负极发生氧化反应,则充电时Mg箔上得电子发生还原反应,所以为阴极,根据图示,阴极反应式为[Mg2Cl2]2++4e-=2Mg+4Cl-,故A错误;
B.充电时,Mg箔上得电子发生还原反应,为电解池阴极,与电源的负极相连,故B错误;
C.放电时为原电池,原电池中阳离子向正极迁移,Mg箔为负极,Mo箔为正极,所以钠离子通过离子交换膜从右室移向左室,故C正确;
D.放电时负极反应式为2Mg+2Cl--4e-=[Mg2Cl2]2+,所以外电路中通过0.4mol电子时,有0.2molMg转化为Mg2+,负极质量变化为0.2mol×24g/mol=4.8g,故D错误;
故答案为C。

 备战中考寒假系列答案
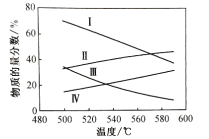
备战中考寒假系列答案【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行