题目内容
| H | + 4 |
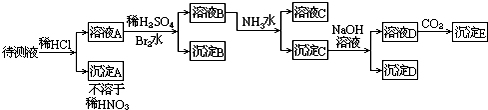
根据实验结果:
(1)写出沉淀D和E的化学式:D
(2).判待测液中有无Ba2+、Ca2+离子?简答:
(3)若溴水参加了反应,此反应的离子方程式是:
根据以上分析完成各题解答.
(1)根据推断可知,D为Fe(OH)3,E为Al(OH)3,
故答案为:Fe(OH)3;Al(OH)3;
(2 )根据以上分析可知,一定含有Ba2+、Ca2+中的一种或两种.因为BaSO4不溶于水,CaSO4微溶于水,沉淀B一定是这两种物质中的一种或两种;
故答案为:两者必有一,或两者同时有;可能是BaSO4,可能是CaSO4,可能是两者的混合物;
(3)若溴水参加反应,说明溶液中一定存在亚铁离子,反应的离子方程式为:2Fe2++Br2=2Fe3++2Br-,
故答案为:2Fe2++Br2=2Fe3++2Br-.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案(9分)用中和滴定法测定某烧碱的浓度。请回答在主要操作过程中的有关问题:
(1)将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。将0.20mol/L的盐酸标准溶液装入酸式滴定管,滴定时,锥形瓶中加2—3滴 作为指示剂;滴定过程中,左手控制活塞,右手旋转摇动锥形瓶,眼睛应注视 ,
当 时即为滴定终点。有关数据如下:
| 滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= ________ |
| 2 | 20.00 | 6.00 | 26.00 | |
(3)若该学生测定值偏大了,则引起测定误差的可能原因是_______________________
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的浓度。请回答他在主要操作过程中的有关问题:
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器除天平、药匙外,还有___ __、 、
、 ;
(2)滴定:①盛装0.20mol/L的盐酸标准溶液应该用________式滴定管,②滴定时,锥形瓶中加2――3滴酚酞作为指示剂,滴定过程中,一支手控制滴定管活塞,另一支手_____________,眼睛应注视__________ ______ _,当__________时即为滴定终点;③有关数据纪录如下:
滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
1 | 20.00 | 0.50 | 20.60 | V(平)= ________ |
2 | 20.00 | 6.00 | 26.00 | |
(3)计算:测得NaOH溶液的浓度为 ____________mol/L,烧碱样品的纯度为 _____。
(4)若该学生测定值偏大了,则该同学引起测定误差的可能原因是____________,
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的纯度。请回答他在主要操作过程中的有关问题:
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器有 ;
(2)滴定:①盛装0.20mol/L盐酸标准溶液应该用 式滴定管;
②滴定时,锥形瓶中加2-3滴 作为指示剂,滴定过程中,左手 ,右手 ,两眼应注视 ,当 时即为滴定终点;
③有关数据记录如下:
| 滴定序号 | 待测验定溶液体积 (ml) | 所消耗盐酸体积(ml) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= |
| 2 | 20.00 | 6.00 | 26.00 | |
(3)计算:测得NaOH溶液的浓度为 mol/L,烧碱样品的纯度为 。
(4)若实验指导教师测得烧碱样品的准确纯度为92.5%,则该同学引起测定误差的可能原因是
A、酸式滴定管用水洗后,未用标准酸液润洗
B、酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C、锥形瓶用蒸馏水洗后,未用碱液洗
D、酸式滴定管,起始读数俯视,滴定后读数仰视
E、在滴定过程中,向锥形瓶中添加蒸馏水
F、取待测液时,碱式滴定管未用碱液洗
G、当指示剂局部变色时,停止滴定


 用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题:
用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题: