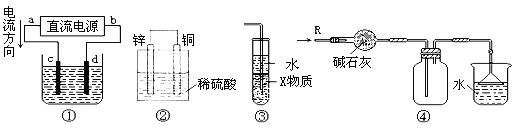
题目内容
【题目】把图2中的物质补充到图1中,可得到一个氧化还原反应的离子方程式。对该氧化还原反应的离子方程式,下列说法不正确的是( )
图1: Mn2+……→H+……
图2:![]()
A. Mn 元素从反应前的+2价升高到了反应后的+7价,Mn2+做还原剂
B. I![]() 作氧化剂,具有氧化性
作氧化剂,具有氧化性
C. 随着反应的进行,溶液酸性增强
D. 若有2 mol Mn2+参加反应,则转移5 mol电子
【答案】D
【解析】根据氧化还原反应一定有化合价的升高和降低以及原子个数守恒得到该反应为:![]() (未配平)。Mn 元素从反应前的+2价升高到了反应后的+7价,所以Mn2+做还原剂,选项A 正确。反应中IO4-中I的化合价(+7)降低为IO3-(I为+5价),所以IO4-为氧化剂,具有氧化性,选项B正确。反应会生成氢离子,所以随着反应的进行,溶液的酸性增强。选项C正确。Mn 元素从反应前的+2价升高到了反应后的+7价,所以若有2 mol Mn2+参加反应,则转移10 mol电子,选项D错误。
(未配平)。Mn 元素从反应前的+2价升高到了反应后的+7价,所以Mn2+做还原剂,选项A 正确。反应中IO4-中I的化合价(+7)降低为IO3-(I为+5价),所以IO4-为氧化剂,具有氧化性,选项B正确。反应会生成氢离子,所以随着反应的进行,溶液的酸性增强。选项C正确。Mn 元素从反应前的+2价升高到了反应后的+7价,所以若有2 mol Mn2+参加反应,则转移10 mol电子,选项D错误。

 应用题作业本系列答案
应用题作业本系列答案【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。

【题目】下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(1)在元素①~⑧中,金属性最强的元素是_____________(填元素符号),最不容易形成化合物的元素是______________(填元素符号)。
(2)用电子式表示⑦的气态氢化物的形成过程________________________。
(3)③、④、⑥中原子半径由大到小的顺序是____________________(填元素符号)。