题目内容
【题目】如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100 mL CuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
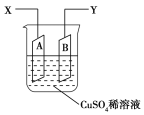
(1)当以I A的电流电解6 min后,测得铜片A质量减少2.56 g,则图装置中的X端应与直流电的________极相连。
(2)电解后将电源反接,2I A的电流电解6 min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1 mol/L,则原溶液中CuSO4物质的量浓度________mol/L。溶液中H+的物质的量浓度为________mol/L。
(3)列式计算实验测得阿伏加德罗常数NA(用I表示)________mol-1。(已知电子电量e=1.60×10-19 C)
【答案】(8分,每空2分)
(1)正
(2)0.5 0.8
(3)2.8I×1022
【解析】考查了阿伏加德罗常数的测定,电解原理的应用的相关知识。(1)铜片A的质量减少了,铜失去电子发生氧化反应,表明A是阳极,X端应与直流电的正极相连。(2)当以I A的电流电解6 min后,测得铜片A的质量减少了2.56 g,铜的物质的量为![]() =0.04 mol,转移电子的物质的量为0.08 mol,石墨上析出0.04 mol铜,电解后将电源反接,铜作阴极,石墨作阳有,首先,析出的铜放电溶解,转移电子0.08 mol,然后电解硫酸铜溶液,方程式为2CuSO4+2H2O
=0.04 mol,转移电子的物质的量为0.08 mol,石墨上析出0.04 mol铜,电解后将电源反接,铜作阴极,石墨作阳有,首先,析出的铜放电溶解,转移电子0.08 mol,然后电解硫酸铜溶液,方程式为2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑,以2I A的电流电解6 min后,转移电子的物质的量为0.08 mol×2=0.16 mol,则电解的硫酸铜的物质的量为
2H2SO4+2Cu+O2↑,以2I A的电流电解6 min后,转移电子的物质的量为0.08 mol×2=0.16 mol,则电解的硫酸铜的物质的量为![]() =0.04 mol;原溶液中CuSO4物质的量浓度为
=0.04 mol;原溶液中CuSO4物质的量浓度为![]() +0.1 mol/L=0.5 mol/L,生成的硫酸的物质的量为0.04 mol×2=0.08 mol/L,物质的量浓度为
+0.1 mol/L=0.5 mol/L,生成的硫酸的物质的量为0.04 mol×2=0.08 mol/L,物质的量浓度为![]() =0.8 mol/L。(3)当以I A的电流电解6 min后,测得铜片A的质的量减少了2.56 g,铜的物质的量为
=0.8 mol/L。(3)当以I A的电流电解6 min后,测得铜片A的质的量减少了2.56 g,铜的物质的量为![]() =0.04 mol,转移电子的物质的量为0.08 mol,根据Q=It=I A×6×60 s=0.08 mol×NA/mol×1.60×10-19 C,因此NA=2.8I×1022。
=0.04 mol,转移电子的物质的量为0.08 mol,根据Q=It=I A×6×60 s=0.08 mol×NA/mol×1.60×10-19 C,因此NA=2.8I×1022。

【题目】研究有机物的结构是更好的应用有机物的前题
(1)![]() 和
和![]() 两种有机物可以互溶,其有关性质如下表:
两种有机物可以互溶,其有关性质如下表:
相对密度/( | 熔点 | 沸点 | 溶解性 | |
|
|
|
| 不溶于水 |
|
|
|
| 与水以任意比混溶 |
①要除去![]() 和
和![]() 的混合物中的
的混合物中的![]() ,可用用_________方法即可得到较纯净
,可用用_________方法即可得到较纯净![]() 。
。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
②为测定![]() 的结构,进行如下实验:将一定量
的结构,进行如下实验:将一定量![]() 置于氧气流中充分燃烧,实验测得生成
置于氧气流中充分燃烧,实验测得生成![]() 和
和 ![]() ,消耗氧气6.72 L(标准状况下),质谱仪测定该有机物相对分子量为
,消耗氧气6.72 L(标准状况下),质谱仪测定该有机物相对分子量为![]() ,则该有机物的分子式为__________;写出
,则该有机物的分子式为__________;写出![]() 的所有可能的结构简式____________________________________。
的所有可能的结构简式____________________________________。
③若质谱图显示![]() 的相对分子质量为
的相对分子质量为![]() ,红外光谱提示有对称
,红外光谱提示有对称![]() ,对称
,对称![]() ,有
,有![]() 键则
键则![]() 的结构简式为____________________________________。
的结构简式为____________________________________。
(2)在常温下测定相对分子质量为![]() 的某烃的核磁共振氢谱,若为链烃,观察到两种类型的
的某烃的核磁共振氢谱,若为链烃,观察到两种类型的![]() 原子给出的信号,其强度之比为
原子给出的信号,其强度之比为![]() ,且则该烃的结构简式为____________________________________,若为芳香,其一氯代物有
,且则该烃的结构简式为____________________________________,若为芳香,其一氯代物有![]() 种,则该烃的结构简式为______________________。
种,则该烃的结构简式为______________________。
(3)某烯烃![]() ,相对分子质量为
,相对分子质量为![]() ,
,![]() 与
与![]() 发生加成反应得到的烷烃只能由这种存在顺反异构的烯烃
发生加成反应得到的烷烃只能由这种存在顺反异构的烯烃![]() 与氢气加成得到,则该烯烃的顺式的结构简式为________,名称为________。
与氢气加成得到,则该烯烃的顺式的结构简式为________,名称为________。