题目内容
在1L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol·L-1的H2SO4溶液,所产生的沉淀的物质的量和所加入硫酸溶液的体积关系可用下列图像表示的是( )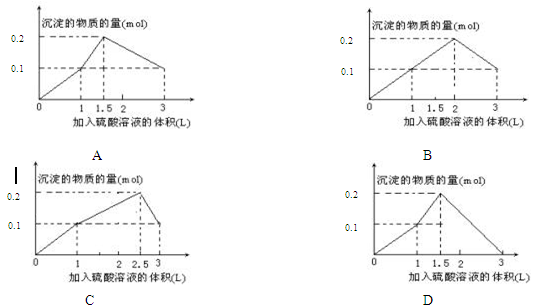

A
向0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入0.1 mol·L-1的H2SO4溶液,先与Ba(OH)2反应,需消耗硫酸的物质的量为0.1 mol,即消耗硫酸溶液的体积为1L,在这个过程中,恰好完全反应生成BaSO4和H2O,再逐滴滴入H2SO4与NaAlO2反应,其离子方程式为H++ALO2—+H2O=AL(OH)3↓;当加入硫酸的物质的量达到0.05mol时,ALO2—全部转化为AL(OH)3↓;再加入硫酸,AL(OH)3逐渐溶解,其反应离子方程式为AL(OH)3+3H+=AL3++3H2O;当加入硫酸的物质的量达到0.15mol时,AL(OH)3全部溶解,再加入硫酸,沉淀质量不变。
综上所述,正确选项为A;
综上所述,正确选项为A;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)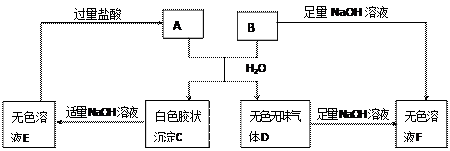
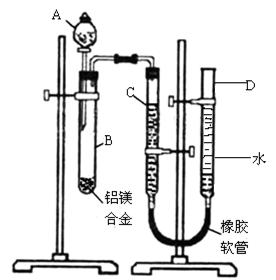
 Cl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为
Cl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为