题目内容
某密闭容器中充入一定量A、B,发生反应2A(g)+B(g)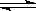 2C(g),测得C浓度与反应温度关系如图。下列说法正确的是
2C(g),测得C浓度与反应温度关系如图。下列说法正确的是
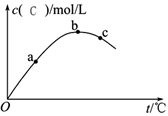
A.该反应ΔH>0 B.
B. A的转化率:a>b>c
A的转化率:a>b>c
C.平衡常数K:c>b>a D.化学反应速率:c>b>a
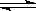 2C(g),测得C浓度与反应温度关系如图。下列说法正确的是
2C(g),测得C浓度与反应温度关系如图。下列说法正确的是
A.该反应ΔH>0
 B.
B. A的转化率:a>b>c
A的转化率:a>b>cC.平衡常数K:c>b>a D.化学反应速率:c>b>a
D
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
题目内容
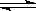 2C(g),测得C浓度与反应温度关系如图。下列说法正确的是
2C(g),测得C浓度与反应温度关系如图。下列说法正确的是
 B.
B. A的转化率:a>b>c
A的转化率:a>b>c
 阅读快车系列答案
阅读快车系列答案