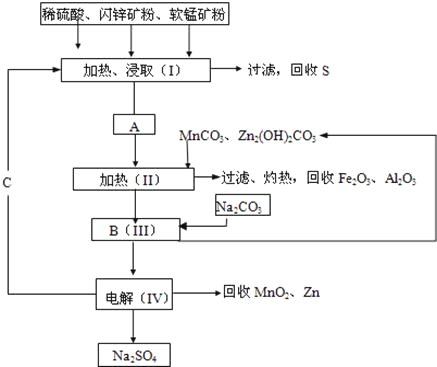
��Ŀ����
����Ŀ��
(1)�����£�����������������ʢװŨ�����ԭ���� ��
(2)����������������װNaOH�ȼ���Һ��ԭ����(�����ӷ���ʽ��ʾ) ��
(3)��ҵ��ұ��������Ӧ�Ļ�ѧ����ʽΪ ��
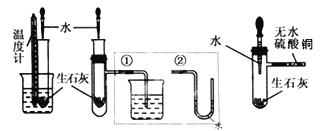
(4)ijʵ��С��������ͼװ����֤����ˮ�����ķ�Ӧ��

��ʪ���������� ���Թ��з�Ӧ�Ļ�ѧ����ʽ�� ��
��ʵ�������ȡ��������Ӧ��Ĺ������Թ��У�����������ᣬ������ȫ�ܽ⣬������Һ�д��ڵ��������� (�����)��
a��һ����Fe2+��H+��Fe3+b��һ����Fe2+��H+��������Fe3+
c��һ����Fe2+��Fe3+��������H+d��һ����Fe3+��H+��������Fe2+
���𰸡�(1)Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ(��ʹ�������ۻ�)
(2)2Al+2OH��+6H2O=2[Al(OH)4]��+3H2��
(3)2Al2O3![]() 4Al+3O2��
4Al+3O2��
(4)���ṩˮ������3Fe+4H2O(g)![]() Fe3O4+4H2����b
Fe3O4+4H2����b
�����������������(1)�����£�Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ(��ʹ�������ۻ�)����������������ʢװŨ���ᣬ�ʴ�Ϊ��Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ(��ʹ�������ۻ�)��
(2)������NaOH��Һ��Ӧ����Ӧ�����ӷ���ʽΪ2Al+2OH��+6H2O=2[Al(OH)4]��+3H2�����ʴ�Ϊ��2Al+2OH��+6H2O=2[Al(OH)4]��+3H2����
(3)��ҵ���õ���������ķ���ұ��������Ӧ�Ļ�ѧ����ʽΪ2Al2O3![]() 4Al+3O2�����ʴ�Ϊ��2Al2O3
4Al+3O2�����ʴ�Ϊ��2Al2O3![]() 4Al+3O2����
4Al+3O2����
(4)����Ϊ������ˮ�����ķ�Ӧ���Թ��������ۣ�����ʪ����Ҫ���ṩˮ���������ڸ�������ˮ��Ӧ������������������������Ӧ����ʽΪ��3Fe+4H2O![]() Fe3O4+4H2���ʴ�Ϊ���ṩˮ������3Fe+4H2O
Fe3O4+4H2���ʴ�Ϊ���ṩˮ������3Fe+4H2O![]() Fe3O4+4H2��
Fe3O4+4H2��
������ˮ������Ӧ������Ϊ����������������������������ᣬ������ȫ�ܽ⣬�ط�����Ӧ��Fe3O4+8HCl=FeCl2+2FeCl3+4H2O������������Һ�д��ڵ���������һ����Fe2+��H+��������������ɫ�����п��ܺ��й������������ܽ�����������ȫ��ת���ɶ��������ӣ�Fe+2Fe3+�T3Fe2+������������Һ�д��ڵ���������һ����Fe2+��H+��������Fe3+���ʴ�Ϊ��b��

 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�