��Ŀ����
����Ŀ���Ի�ͭ����Ҫ�ɷ���CuFeS2������������SiO2��Ϊԭ����ͭ�ķ����в�ͬ��ұ������������ͭ������ͭ��Cu2S���ڿ����и��±��ռ��ɵõ�ͭ��һ�ֻ�ԭ�Ե����塣��������ʪ����ͭ�����½�չ����ѧ�ҷ�����һ��ϸ��������ˮ��Һ�����������£����Խ���ͭ�������������Ρ�ij�������ø�ԭ������ͭ���̷���FeSO47H2O���Ĺ������£�
�ش��������⣺
��1������ͭ�����Ļ�ѧ����ʽ��_________________________��
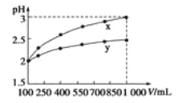
��2��ʪ����ͭ���������У�Ϊ��������ʱ�Ľ�ȡ�ʣ������̿ɲ�ȡ�Ĵ�ʩ��________���Լ�XΪ__________����������_____________��
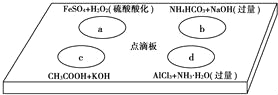
��3���Լ�aΪ______________���Լ�bΪ______________��
��4����ƽ��Ӧ1�Ļ�ѧ����ʽ��____CuFeS2+___H2SO4+____O2=____CuSO4+____Fe2��SO4��3+____H2O
��5����֪��������Ksp[Cu��OH��2]=2.2��10-20��Ksp[Fe��OH��3]=2.6��10-39������������Լ�X����pH=4ʱ����ʹ��Һ�е�Fe3+ת��ΪFe��OH��3����������Һ�е�c��Fe3+��=___________����Ҫ��ʱ������Cu��OH��2����������Һ�е�Cu2+Ũ�������_________________��
���𰸡���1��Cu2S+O2![]() 2Cu+SO2��2�֣� ��2�����裨�������������۴��������ܵ÷֣���1�֣� CuO��CuCO3��Cu��OH��2��1�֣� ����pH��ʹ�����ӳ�������2�֣���3��H2SO4��1�֣���Fe��1�֣�(4) 4��2��17��4��2��2��2�֣� (5)2.6��10-9 mol/L��2�֣�;2.2mol/L��2�֣�
2Cu+SO2��2�֣� ��2�����裨�������������۴��������ܵ÷֣���1�֣� CuO��CuCO3��Cu��OH��2��1�֣� ����pH��ʹ�����ӳ�������2�֣���3��H2SO4��1�֣���Fe��1�֣�(4) 4��2��17��4��2��2��2�֣� (5)2.6��10-9 mol/L��2�֣�;2.2mol/L��2�֣�
��������
�����������1������ͭ��ԭ���ǽ���ͭ��Cu2S���ڿ����и��±��ռ��ɵõ�ͭ��һ�ֻ�ԭ�Ե����壬�������Ƕ���������˷�Ӧ�ķ���ʽΪCu2S+O2![]() 2Cu+SO2��
2Cu+SO2��
��2�����������¶Ȼ��ƻ������ʣ����Ϊ��������ʱ�Ľ�ȡ�ʣ������̿ɲ�ȡ�Ĵ�ʩ�ǽ��裻���ڲ������������ʣ������ٵ�����Һ��pHֵ����������ʱӦ��ѡ������ͭ������������̼��ͭ�ȡ�
��3�����ڼ�������ͭ������Һ��pH�����������������������ʹ���A�� Fe��OH��3��Ҫ�Ʊ��̷�������Ҫ����ϡ���ᣬ�õ���������Ȼ���ټ������۵õ������������ɣ���a�����ᣬb������
��4�����ݷ���ʽ��֪��Ԫ�صĻ��ϼ۴���2�����ߵ���3�ۣ�ʧȥ1�����ӣ�SԪ�صĻ��ϼ۴ӣ�2�����ߵ���6�ۣ�ʧȥ8�����ӣ���1mol CuFeS2ʧȥ17mol���ӣ�1mol�����õ�4mol���ӣ���˸��ݵ��ӵ�ʧ�غ��֪��Ӧ�ķ���ʽΪ4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2��SO4��3+2H2O��
��2��pH��4ʱ��Һ��������Ũ����10��10mol/L������������������ܶȻ�������֪��Һ��c��Fe3+����![]() ��2.6��10-9 mol/L������������ͭ���ܶȻ�������֪��ʱ��Һ��ͭ����Ũ�ȣ�
��2.6��10-9 mol/L������������ͭ���ܶȻ�������֪��ʱ��Һ��ͭ����Ũ�ȣ�![]() ��2.2mol/L�������Ҫ��ʱ������Cu��OH��2����������Һ�е�Cu2+Ũ�������2.2mol/L��
��2.2mol/L�������Ҫ��ʱ������Cu��OH��2����������Һ�е�Cu2+Ũ�������2.2mol/L��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�