��Ŀ����
����Ŀ������ѧ����ѡ��2����ѧ�뼼����
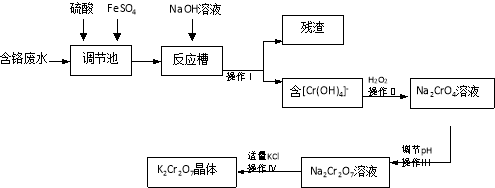
ij���������̿�MnO2Լ70% ��A12O3������п��ZnSԼ80����FeS����ͬ����MnO2��Zn���ɵ��ԭ�ϣ���
��֪����A��![]() �Ļ��Һ��
�Ļ��Һ��
��IV�еĵ�ⷽ��ʽΪ��![]()
��l��A�����ڻ�ԭ�������________________________��
��2������MnCO3��Zn2��OH��2CO3������ ________________________��
II��Ҫ���ȵ�ԭ���ǣ�____________________��C�Ļ�ѧʽ�� _______________��
��3���������г��õ�MnO2��Zn���⣬���ɵõ��ĸ���Ʒ��_________________��
��4����������������е���ģ�����ʯ�⣬�蹺��Ļ���ԭ����_____________��
��5��Ҫ��Na2SO4��Һ�еõ�â����Na2SO4��10H2O��������еIJ���������Ũ����___________�����ˡ�ϴ�ӡ�����ȡ�
��6��������MnO2��Zn�ĽǶȼ��㣬���̿����п��������ȴ�Լ��__________��
���𰸡���1��MnSO4 ��2�֣�
��2��������Һ��PH��ʹFe3+��Al3+�����ɳ�����2�֣����ٽ�Fe3+��Al3+��ˮ����2�֣���H2SO4��1�֣�
��3��Fe2O3��Al2O3��S��Na2SO4��2�֣�
��4�������������2�֣���5����ȴ�ᾧ����2�֣� (6) 1.03��2�֣�
��������
�����������1����������ԭ��Ӧ�У����ϼ۽���Ԫ�����ڵIJ����ǻ�ԭ����Ƚ���Ϣ����A�����̿���Ԫ�ػ��ϼ۵ı仯��֪����Ԫ�ػ��ϼ۴�+4�۽���Ϊ+2�ۣ�����A�л�ԭ����ΪMnSO4��
��2�����ݿ�ͼ����MnSO4��ZnSO4��Fe2��SO4��3��Al2��SO4��3�Ļ��Һ�м���MnCO3��Zn2��OH��2CO3����Ի���������������������Լ���MnCO3��Zn2��OH��2CO3�����þ��ǵ���pH��ʹFe3+��Al3+������ȫ���ڼ��ȵĻ����£����������ӵ�ˮ������ף������γɳ��������룬����IV�еĵ�ⷴӦʽΪ��MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4����֪CΪ���
MnO2+Zn+2H2SO4����֪CΪ���
��3����ʵ���Ŀ�ľ����Ʊ�����������п���������Ҫ������������Ԫ�ء���Ԫ�س�ȥ����������ͼ���ѵó��������г��õ�MnO2��Zn���⣬���ɵõ��ĸ���Ʒ��������������������
��4�����ݿ�ͼ��ת�����ĵķ�Ӧ���������������е���ģ�����ʯ�⣬�蹺��Ļ���ԭ����̼���������
��5��Ҫ��Na2SO4��Һ�еõ�â����Na2SO4��10H2O��������еIJ���������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ȣ�
��6���ݷ�ӦMnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4��֪MnO2��Zn�����ʵ���֮��Ϊ1��1���ʿ������̿���п��������ֱ�Ϊx��y����0��7x ��87��0��8y��97��1��1�����x��y=1.03��
MnO2+Zn+2H2SO4��֪MnO2��Zn�����ʵ���֮��Ϊ1��1���ʿ������̿���п��������ֱ�Ϊx��y����0��7x ��87��0��8y��97��1��1�����x��y=1.03��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�����Ŀ��һ��ԭ��ص��ܷ�Ӧ�����ӷ���ʽ��Zn��Cu2��===Zn2����Cu����ԭ��صĺ������
���� | ���� | �������Һ | |
A | Zn | Cu | CuCl2 |
B | Cu | Zn | H2SO4 |
C | Cu | Zn | CuSO4 |
D | Zn | Fe | CuCl2 |
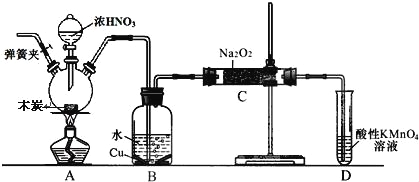
����Ŀ����1����O2��HC1ת��ΪCl2�������Ч�棬������Ⱦ����ͳ�ϸ�ת��ͨ������ͼ��ʾ�Ĵ���ѭ��ʵ�֣�
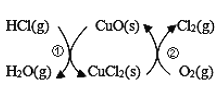
���У���Ӧ��Ϊ��2HCl(g)+CuO(s) ![]() H2O(g)+CuCl2��s�� ��H1����Ӧ������1 mol Cl2 (g)�ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ____________________________������Ӧ������H1����H2��ʾ����
H2O(g)+CuCl2��s�� ��H1����Ӧ������1 mol Cl2 (g)�ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ____________________________������Ӧ������H1����H2��ʾ����
��2��һ�������²��������Ӧ������c(Cl2)���������£�
t��min�� | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
����2.0��6.0min����HCl�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���� _________��
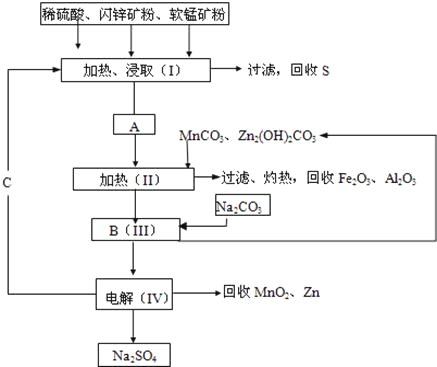
��3�������£�����ȥ��������Ĥ��Al��CuƬ����ŨHNO3�����ԭ��أ�ͼ1�������ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ2��ʾ����Ӧ�������к���ɫ���������
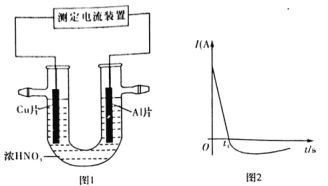
0��tlʱ��ԭ��صĸ�����AlƬ����ʱ�������ĵ缫��Ӧʽ��______________����Һ�е�H+��______���ƶ���tlʱ��ԭ����е��������������ı䣬��ԭ����_____________��