题目内容
(1)NA为阿伏加德罗常数。25℃时,1g水中含H+离子个数约为__________NA。
(2)通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________,这样所得硝酸的质量分数为_____________。
(3)往含0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5 mol。请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图。(不计弱电解质的电离和盐的水解)

(4)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为0.4, 480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)
(2)通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________,这样所得硝酸的质量分数为_____________。
(3)往含0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5 mol。请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图。(不计弱电解质的电离和盐的水解)

(4)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为0.4, 480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)
(1)10-10 (2分)
(2)1:2 0.778 (4分)
(3)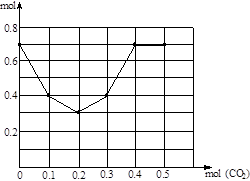
(0,0.7) (0.1,0.4) (0.2,0.3) (0.3,0.4) (0.4,0.7) (0.5,0.7) (5分)
(4)(4分)解 m(Cu) = 480×0.4=192g m(CuO)=480g-192g=288g
n(Cu) =192/64=3mol, n(CuO) = 288/80=3.6mol (1分)
n(Cu) +n(CuO)="3mol" +3.6mol = 6.6mol
由Cu守恒得: n(H2SO4)=n(CuSO4·5H2O)=6.6mol(1分)
m(CuSO4·5H2O)=6.6mol×250g/mol=1650g
设HNO3为xmol ,由得失电子数相同得: 2×480×0.4/64=3x x=2
n(HNO3) ="2mol" 则放出NO为2mol,质量为2×30=60g(1分)
根据质量守恒:m(溶液)=1650+2×30-480=1230g(1分)
所以,H2SO4%=6.6×98/12300×100%=52.6%(1分)
(2)1:2 0.778 (4分)
(3)
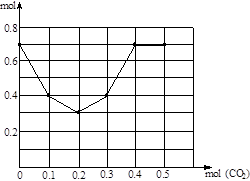
(0,0.7) (0.1,0.4) (0.2,0.3) (0.3,0.4) (0.4,0.7) (0.5,0.7) (5分)
(4)(4分)解 m(Cu) = 480×0.4=192g m(CuO)=480g-192g=288g
n(Cu) =192/64=3mol, n(CuO) = 288/80=3.6mol (1分)
n(Cu) +n(CuO)="3mol" +3.6mol = 6.6mol
由Cu守恒得: n(H2SO4)=n(CuSO4·5H2O)=6.6mol(1分)
m(CuSO4·5H2O)=6.6mol×250g/mol=1650g
设HNO3为xmol ,由得失电子数相同得: 2×480×0.4/64=3x x=2
n(HNO3) ="2mol" 则放出NO为2mol,质量为2×30=60g(1分)
根据质量守恒:m(溶液)=1650+2×30-480=1230g(1分)
所以,H2SO4%=6.6×98/12300×100%=52.6%(1分)
试题分析:(1)水电离出的C(H+)=1.0×10-7mol?L?1, 1g水中含H+为:1g÷1000g/L×1.0×10-7mol?L?1=10-10mol。
(2)氨的催化氧化法制取硝酸发生如下反应:4NH3+5O2
 4NO+6H2O、4NO+3O2+2H2O=4HNO3,所以氨与所耗氧气的物质的量比为:1:2;根据化学方程式可以看出:生成4molHNO3,最终得4molH2O,所得硝酸的质量分数=4mol×63g/mol÷(4mol×63g/mol+4mol×18g/mol)= 0.778。
4NO+6H2O、4NO+3O2+2H2O=4HNO3,所以氨与所耗氧气的物质的量比为:1:2;根据化学方程式可以看出:生成4molHNO3,最终得4molH2O,所得硝酸的质量分数=4mol×63g/mol÷(4mol×63g/mol+4mol×18g/mol)= 0.778。(3)通入CO2前,0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液共含离子0.7mol,折线起点坐标(0,0.7),通入CO2首先发生反应:CO2+Ca2++2OH?=CaCO3↓+H2O,完全反应消耗0.1molCO2,减少0.3mol离子,得转折点坐标(0.1,0.4),继续通入CO2,发生第2步反应:CO2+2OH?=CO32?+H2O ,本步反应消耗CO2 0.1mol,离子减少0.1mol,得第2个转折点(0.2,0.3),第3步反应:CO2+CO32?+H2O=2HCO3?,消耗CO2 0.1mol,离子增加0.1mol,得第3个转折点(0.3,0.4),第4步反应:CO2+CaCO3+H2O=Ca2++2HCO3?,消耗CO2 0.1mol,离子增加0.3mol,得第4个转折点(0.4,0.7),因为不计弱电解质的电离和盐的水解,再通入CO2,离子浓度不变,得终点(0.5,0.7),连接各点得转折线。
(4)硫酸的质量根据元素守恒求算,n(H2SO4)=n(CuSO4·5H2O)="n(Cu)+n(CuO)," 题目已给条件:固体混合物的总质量为480 g,铜屑的质量分数为0.4,分别求出Cu、CuO的质量,进而求出物质的量;混酸溶液的质量根据质量守恒定律求算,反应前固体混合物的质量+混酸溶液的质量=反应后CuSO4·5H2O的质量+NO的质量,最后可求出H2SO4的质量分数。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为  Na2SO4+2HCl↑
Na2SO4+2HCl↑ Na2S+2CO2↑
Na2S+2CO2↑