题目内容
硫酸是重要的化工产品,在基础化学实验中,有着重要的作用。
(1)物质的量浓度为18.4mol/L,质量分数为0.98的浓硫酸吸收水蒸气时,当其质量分数下降到0.87(密度1.8g•cm-3)以下时,则失去干燥能力。 质量分数为0.87的硫酸的物质的量浓度为
(保留两位小数,下同)。50mL 18.4mol/L的浓硫酸作为干燥剂时,最多可吸水___________g。
(2)工业上以高岭土和硫酸.氨气为原料制取铵明矾[NH4Al(SO4)2·12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O…………①
Al2(SO4)3 + H2SO4 + 2NH3 → 2NH4Al(SO4)2 …………②
某工厂欲同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时氧化铝和硫酸的物质的量之比是
(3)硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为_____。
(4)将上述炉气经净化除尘后直接送入接触室,气体体积减少了5%(同温同压下测定),试计算SO2的转化率
(1)(4分)15.98 mol·L-1 11.63 (2)(2分) 3:10
(3)(3分) 0.11 (4)(3分) 93%;
【解析】
试题分析:(1)C=n/v=1.8*0.87*1000/98*1=15.98 (mol·L-1 )
解:设硫酸吸水的质量为x 根据溶质的质量不变
18.4*50*0.98=(x+18.4*50)*0.87 x=116.3
(2)解:设铵明矾和硫酸铝的物质的量为x
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O…………①
3/2 x 9x/2 3/2 x
Al2(SO4)3 + H2SO4 + 2NH3 → 2NH4Al(SO4)2 …………②
1 1 2
x/2 x/2 x
氧化铝和硫酸的物质的量之比是: 3/2 x:( 9x/2+ x/2)= 3:10
(3)解:设空气的体积为a
4FeS2+11O2=2Fe2O3+8SO2
11 8
a*20% 0.145a
SO2的体积分数为:0.145a *100%/(1+40%)a*80%+ 0.145a =0.108 a 近似为0.11 a
(4)2SO2+ O2=2 SO3 ⊿V
2 1 1
10%a 5%a
SO2的转化率为:10%a*100%/0.108 a=93%
考点:本题以工业生产为基础,考查化学计算等知识。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案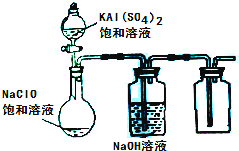 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.