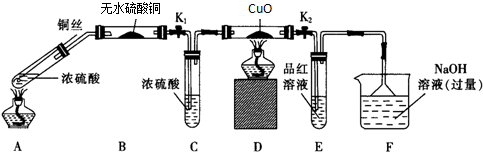
题目内容
15.某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液加入少量溴水,溶液呈无色.继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g.滤液加足量NaOH溶液、加热,生成气体在标准状况下体积为1120mL.根据上述实验,以下推测正确的是( )| A. | 原溶液肯定只存在NH4+、SO32- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
分析 某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液加入少量溴水,溶液呈无色,说明溶液中无Fe3+,且有还原性离子将Br2还原,且所得产物无色,由于还原性SO32->I-,故溶液中可能不含I-,也可能I-未反应,但溶液中一定含SO32-,由于有SO32-则无Ba2+;继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,此沉淀为BaSO4,沉淀经洗涤、高温干燥后质量为4.66g,即BaSO4的物质的量为0.02mol,但由于溶液中一定含SO32-,故生成的0.02molBaSO4中的SO42-可能全部来自于被氧化的SO32-,也可能溶液中原来含有SO42-;滤液加足量NaOH溶液、加热,生成气体为NH3,即原来溶液中一定含NH4+,在标准状况下体积为1120mL,故NH4+的物质的量为0.05mol,根据溶液的电中性来判断K+的存在.
解答 解:某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种.
现取100mL溶液加入少量溴水,溶液呈无色,说明溶液中无Fe3+,且有还原性离子将Br2还原,且所得产物为无色,由于还原性SO32->I-,故溶液中可能不含I-,也可能有I-但未反应,故溶液中一定含SO32-,由于Ba2+与SO32-不能共存,故溶液中无Ba2+;
继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,此沉淀为BaSO4,沉淀经洗涤、高温干燥后质量为4.66g,即BaSO4的物质的量为0.02mol,即SO42-的物质的量为0.02mol,但由于溶液中一定含SO32-,故生成沉淀中的0.02molSO42-可能全部来自于被氧化的SO32-,也可能部分是溶液中原来含有SO42-,但SO32-和SO42-的物质的量之和必须为0.02mol;
滤液加足量NaOH溶液、加热,生成气体为NH3,即原来溶液中一定含NH4+,在标准状况下体积为1120mL,故NH4+的物质的量为0.05mol.
由于0.02molSO32-(或SO32-和SO42-)带0.04mol负电荷,而0.05molNH4+带0.05mol正电荷,而溶液要保持电中性,故溶液中一定含I-,可能含K+.
即溶液中一定含NH4+、SO32-、I-;一定不含:Ba2+、Fe3+;可能含SO42-、K+.
A、溶液中一定含NH4+、SO32-、I-,可能含SO42-、K+,故A错误;
B、I-一定存在,故B错误;
C、溶液中可能存在可能含SO42-、K+,故C正确;
D、另取试液滴加足量盐酸、BaCl2溶液,只能检验出溶液中含不含SO42-,对K+的存在不能确定,故D错误.
故选C.
点评 本题考查了溶液中离子的检验和确定,应注意根据溶液的电中性来确定I-的存在,难度较大.

 综合自测系列答案
综合自测系列答案| A. | 水玻璃可用作木材防火剂 | B. | 用大量的二氧化硫作食品漂白剂 | ||
| C. | 硅可用于制造太阳能电池 | D. | 食醋可作除去保温瓶的水垢 |
| A. | 电解水若生成33.6L(标准状况)气体时电路中通过的电子数目为2NA | |
| B. | 5NH4NO3=2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移电子数目为7.5NA | |
| C. | 用2mL5mol/L的FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.01NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
| A. | 可用CCl4萃取碘酒中的碘 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物为一定为钾盐 | |
| C. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| D. | 室温下,浓度为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
| 选项 | 实验目的 | 操作 |
| A | 从溴水中提取单质溴 | 先用CCl4 萃取分液后,再蒸馏 |
| B | 证明 Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3 溶液 |
| C | 验证蔗糖是否水解生成葡萄糖 | 向蔗糖溶液中加入少量稀硫酸加热,再加入少量NaOH溶液,调至碱性,然后加银氨溶液水浴加热 |
| D | 证明碱的非金属性强于硅 | 向NaSiO3溶液中通入适量CO2 气体,有白色胶状沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| B. | 为了防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “碳纳米泡沫”倍称为第五形态的单质碳,它与石墨弧称为同位素 | |
| D. | 海水淡化能解决淡水供应危机,向海水中加入净水剂明矾可以使海水淡化 |
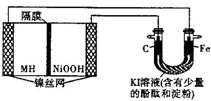 如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )
如图中的左侧装置是一种金属氢化物镍电池,其中的MH是吸附了氢原子的储氢合金,电解质溶液KOH.右侧装置是一电解池,电极材料及电解质溶液如图所示,下列有关此实验的叙述中,正确的是( )| A. | 放电时负极反应为:MH+OH-=M+H2O+e- | |
| B. | 充电时隔膜旁的OH-从右向左移动 | |
| C. | 右侧装置中的铁电极附近溶液呈蓝色 | |
| D. | 右侧装置中的碳电极表面逸出无色、无味的气体 |