��Ŀ����
����Ŀ�����ɷ��Ǹ��л�ѧѧϰ���õķ���֮һ��ij��ѧ�о���ѧϰС����ѧϰ�ˡ���ѧ��Ӧԭ���������������µĹ����ܽ������ȷ����
����0.1 mol��L��1 CH3COOH��Һ�м������������ᣬƽ��������Ӧ�����ƶ�������̶�����
�������£�pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������ϣ�����c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
�������£�AgCl��ͬ���ʵ���Ũ�ȵ�CaCl2��NaCl��Һ�е��ܽ����ͬ��
�������£���֪�������ƽ�ⳣ��ΪKa�������ˮ��ƽ�ⳣ��ΪKh��ˮ�����ӻ�
A���٢ڢ� B���ڢ� C���ڢ� D���٢ڢۢ�
���𰸡�B
��������
�������������0.1 mol��L��1 CH3COOH��Һ�м������������ᣬ�����Ũ��������̶ȼ�С�����������ݵ���غ㣬pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������ϣ�����c(Na+)+c(H+)=c(OH-)+c(CH3COO-)����ȷ����ͬ���ʵ���Ũ�ȵ�CaCl2��NaCl��Һ��������Ũ�Ȳ��ȣ���AgCl���ܽ�Ȳ�ͬ�������������£���֪�������ƽ�ⳣ��ΪKa=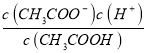 �������ˮ��ƽ�ⳣ��ΪKh=
�������ˮ��ƽ�ⳣ��ΪKh=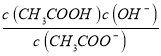 ��ˮ�����ӻ�ΪKw= c(H+)��c(OH-)�����KaKh=Kw����ȷ����ѡB��
��ˮ�����ӻ�ΪKw= c(H+)��c(OH-)�����KaKh=Kw����ȷ����ѡB��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����1��![]() H��
H��![]() H��
H��![]() H��Ϊ________��16O2��18O3��Ϊ________��
H��Ϊ________��16O2��18O3��Ϊ________��
A��ͬλ�� | B����ͬ���� |
C��ͬ�������� | D��ͬ���칹�� |
��2��ijԪ�ص�������������ʽR2O5����֪R����̬�⻯���к���8.82%����R�����ԭ����ԼΪ________��RԪ�����ڱ��е�λ��Ϊ________________��
��3��墨���һ�ּ�����γɵĺϽ�7.8 g��������ˮ��Ӧ����0.2 g��������˺Ͻ�����һ����������ǣ�________________��(卑����ԭ����ȡ85.5)
��4��������ͬ��H2O��D2O�������Ʒ�Ӧ���ų��������ڱ���µ����֮��Ϊ________��



