题目内容
(2013?芜湖模拟)现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
|
分析:A、依据弱电解质的电离平衡影响因素分析判断;
B、弱电解质的电离是吸热过程,温度升高,可以促进弱电解质的电离,且水的离子积增大;
C、依据溶液稀释过程中弱电解质存在电离平衡的移动进行分析判断;
D、依据酸碱反应和弱电解质的电离平衡分析比较.
B、弱电解质的电离是吸热过程,温度升高,可以促进弱电解质的电离,且水的离子积增大;
C、依据溶液稀释过程中弱电解质存在电离平衡的移动进行分析判断;
D、依据酸碱反应和弱电解质的电离平衡分析比较.
解答:解:A、在③④中分别加入适量的醋酸铵晶体后,③中溶解形成的醋酸根离子对醋酸弱电解质的电离平衡起到了抑制作用,氢离子浓度减小,pH增大;④中溶解的醋酸根离子与氢离子会结合成弱电解质醋酸,减小了氢离子的浓度,pH增大,故A错误;
B、升高温度,水的离子积增大,弱电解质的电离程度增大,所以氨水中氢氧根离子浓度增大,溶液pH增大;氢氧化钠溶液中氢氧根离子浓度不变,水的离子积增大,溶液中氢离子浓度增大,溶液pH减小;醋酸溶液中,醋酸的电离程度增大,溶液中氢离子浓度增大,溶液的pH减小;盐酸溶液中氢离子浓度不变,溶液的pH不变,故B错误;
C、①氨水pH=11,平衡状态下氢氧根离子浓度为10-3mol/L;②氢氧化钠pH=11,氢氧根离子浓度为10-3mol/L;③醋酸pH=3,平衡状态下氢离子浓度为10-3mol/L;④盐酸pH=3,溶液中氢离子浓度为10-3mol/L;分别加水稀释10倍,碱比酸的pH大,弱碱弱酸存在电离平衡,加水稀释比强酸强碱的pH变化小,所以得到四种溶液的pH大小为①>②>④>③,故C正确;
D、将①氨水PH=11,平衡状态下氢氧根离子浓度为10-3mol/L④盐酸PH=3,溶液中氢离子浓度为10-3mol/L两种溶液等体积混合,氨水中平衡状态下的氢氧根离子与盐酸中的氢离子恰好反应,氨水又电离出氢氧根离子和铵根离子,依据电离方程式NH3?H20?NH4++OH-;HCl=H++Cl-,可知c(Cl-)=5×10-4mol/L,c(NH4+)>5×10-4mol/L,c(OH-)>c(H+),综上所述可知溶液中的离子浓度大小c(NH+4)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选C.
B、升高温度,水的离子积增大,弱电解质的电离程度增大,所以氨水中氢氧根离子浓度增大,溶液pH增大;氢氧化钠溶液中氢氧根离子浓度不变,水的离子积增大,溶液中氢离子浓度增大,溶液pH减小;醋酸溶液中,醋酸的电离程度增大,溶液中氢离子浓度增大,溶液的pH减小;盐酸溶液中氢离子浓度不变,溶液的pH不变,故B错误;
C、①氨水pH=11,平衡状态下氢氧根离子浓度为10-3mol/L;②氢氧化钠pH=11,氢氧根离子浓度为10-3mol/L;③醋酸pH=3,平衡状态下氢离子浓度为10-3mol/L;④盐酸pH=3,溶液中氢离子浓度为10-3mol/L;分别加水稀释10倍,碱比酸的pH大,弱碱弱酸存在电离平衡,加水稀释比强酸强碱的pH变化小,所以得到四种溶液的pH大小为①>②>④>③,故C正确;
D、将①氨水PH=11,平衡状态下氢氧根离子浓度为10-3mol/L④盐酸PH=3,溶液中氢离子浓度为10-3mol/L两种溶液等体积混合,氨水中平衡状态下的氢氧根离子与盐酸中的氢离子恰好反应,氨水又电离出氢氧根离子和铵根离子,依据电离方程式NH3?H20?NH4++OH-;HCl=H++Cl-,可知c(Cl-)=5×10-4mol/L,c(NH4+)>5×10-4mol/L,c(OH-)>c(H+),综上所述可知溶液中的离子浓度大小c(NH+4)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选C.
点评:本题考查了影响弱电解质的电离平衡的因素,酸碱混合时的定性分析和定量计算,pH的计算应用,溶液稀释时的pH变化判断,反应后溶液中的离子浓度大小判断,综合性较强.

练习册系列答案
相关题目
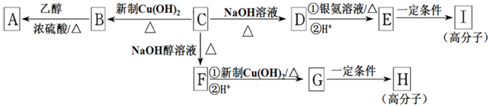



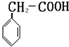 或
或 或
或 或
或
