题目内容
【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
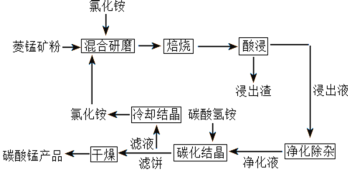
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
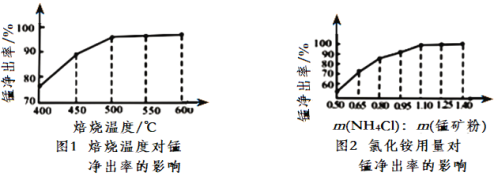
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
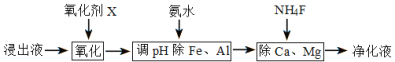
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
【答案】加快反应速率 MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O 温度为500℃ 且 m(MnCO3):m(NH4Cl)=1.10 B 5.2≤pH<8.8 1.97
MnCl2+2NH3↑+CO2↑+H2O 温度为500℃ 且 m(MnCO3):m(NH4Cl)=1.10 B 5.2≤pH<8.8 1.97 ![]() ×10-7 CO32-水解程度大于HCO3-,易生成氢氧化物沉淀
×10-7 CO32-水解程度大于HCO3-,易生成氢氧化物沉淀
【解析】
根据流程:将菱锰矿粉(主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素)和氯化铵混合研磨后焙烧:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+,反应为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,加入碳酸氢铵发生反应:Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+,反应为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,加入碳酸氢铵发生反应:Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O,炭化结晶,过滤,滤饼干燥后得到MnCO3,滤液为NH4Cl溶液,蒸发结晶得到NH4Cl固体,可循环使用,据此分析作答。
MnCO3↓+CO2↑+H2O,炭化结晶,过滤,滤饼干燥后得到MnCO3,滤液为NH4Cl溶液,蒸发结晶得到NH4Cl固体,可循环使用,据此分析作答。
(1)“混合研磨”可使物质充分接触,加快反应速率;
(2)“焙烧”时发生的主要反应的化学方程式为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;
MnCl2+2NH3↑+CO2↑+H2O;
(3) 根据图可知,锰的浸出率随着温度的升高而增大,随着m(NH4Cl):m(锰矿粉)增大而增到,500℃、m(NH4Cl):m(锰矿粉)=1.10时,锰的浸出率最高,温度过高,m(NH4Cl):m(锰矿粉)增大,浸出率变化不大,成本增加,故焙烧温度取500℃、m(NH4Cl):m(锰矿粉)=1.10即可;
(4)①根据分析,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入氧化剂X的目的将Fe2+氧化为Fe3+,同时在选择氧化剂时,要尽可能不要引入新的杂质,则氧化剂X宜选择MnO2,答案选B;
②根据分析,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,过程中不能让Mn2+沉淀,结合相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围表,Al3+、Fe3+完全沉淀时的pH值分别为5.2和2.8,Mn2+开始沉淀的PH值为8.8,pH可取的范围为5.2≤pH<8.8;
③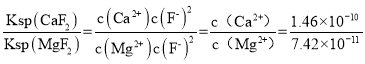 ≈1.97;若此时pH为6,即c(H+)=10-6 mol/L,c(Mg2+)= a mol/L,c(F-)=
≈1.97;若此时pH为6,即c(H+)=10-6 mol/L,c(Mg2+)= a mol/L,c(F-)=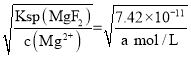 mol/L,HF是弱酸,在溶液中部分电离,已知Ka(HF)=
mol/L,HF是弱酸,在溶液中部分电离,已知Ka(HF)=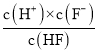 =1.00×104则c(HF)=
=1.00×104则c(HF)=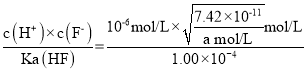 =
= ![]() ×10-7mol/L;
×10-7mol/L;
(5)“碳化结晶”过程中,因为碳酸根离子水解程度大,碳酸铵溶液中c(OH)较大,易产生Mn(OH)2沉淀,故碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液。