题目内容
某二元酸(H2A)按下式发生电离:H2A==H++HA-;HA-== H++A2-。
关于下列四种溶液的说法正确的是
①0.01mol/L的H2A溶液 ②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合 ④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
- A.四种溶液中c(HA-)浓度大小:③>①>②>④
- B.溶液①中一定不存在OH-
- C.溶液③中有关离子浓度关系:c(HA-)+c(A2-)==c(Na+)=0.04mol/L
- D.溶液②中存在水解平衡:HA—+H2O ≒ H2A+OH
A
③0.02mol/L的HCl溶液抑制HA-的电离,④0.02mol/L的NaOH溶液促进④0.02mol/L的NaOH溶液电离,所以四种溶液中c(HA-)浓度大小:③>①>②>④ ,A正确;任何水溶液中都含有 OH-,所以B错;C.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)=0.02ol/L,C错;HA—不发生水解,D错。
③0.02mol/L的HCl溶液抑制HA-的电离,④0.02mol/L的NaOH溶液促进④0.02mol/L的NaOH溶液电离,所以四种溶液中c(HA-)浓度大小:③>①>②>④ ,A正确;任何水溶液中都含有 OH-,所以B错;C.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)=0.02ol/L,C错;HA—不发生水解,D错。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液: H2A+OH―
H2A+OH― H++A2-。现有下列四种溶液①0.0lmol/L的H2A溶液②0.0lmol/L的NaHA溶液
③0.02mol/L的HC1溶液与0.04mol/L的NaHA溶液等体积混合④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
H++A2-。现有下列四种溶液①0.0lmol/L的H2A溶液②0.0lmol/L的NaHA溶液
③0.02mol/L的HC1溶液与0.04mol/L的NaHA溶液等体积混合④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合 H++A2-。关于下列四种溶液的说法正确的是
H++A2-。关于下列四种溶液的说法正确的是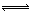 H++A2-。关于下列四种溶液的说法正确的是
( )
H++A2-。关于下列四种溶液的说法正确的是
( )