题目内容
【题目】将等物质的量A、B混合于2 L的密闭容器中,发生如下反应:![]() ,经5 min后,测得D的浓度为0.5 molL-1,
,经5 min后,测得D的浓度为0.5 molL-1,![]() ,
,
C的平均反应速率是0.1 molL-1min-1
求:(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值是多少?
【答案】(1)0.75 mol/L, n(A)= 3moL n(B)=3moL
(2)0.05mol/(L·min) (2分) (3) x=2(2分)
【解析】
试题分析:(1)设原混合物中A、B的物质的量为a,列出起始时和5min时有关物质的物质的量。
3A(g)+B(g)![]() xC(g) + 2D(g)
xC(g) + 2D(g)
起始时(mol) a a 0 0
5min时(mol) a-1.5 a-0.5 0.1×2×5 0.5×2
根据c(A)∶c(B)=3∶5,可得![]() =
=![]() ,解得a=3
,解得a=3
即n(A)=n(B)=3mol,5min时c(A)=![]() =0.75mol/L。
=0.75mol/L。
(2)v(B)=![]() =0.05mol/(L·min)。
=0.05mol/(L·min)。
(3)由化学计量数之比等于物质的量的变化量之比,则![]() =
=![]() ,解得x=2。
,解得x=2。

【题目】某兴趣小组同学欲研究SO2的相关性质。
(1)比较下表中的两组物质关系,第2组中物质X的化学式是 。
第1组 | 第2组 |
C、CO、CO2、H2CO3、Na2CO3、、NaHCO3、 | S 、SO2、SO3、X、Na2SO4、NaHSO4 |
(2)利用下图装置来检验SO2的性质
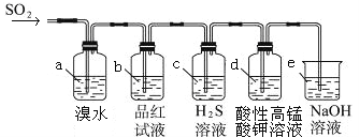
①装置a中的现象是: ; (填“能”或“不能”)说明SO2有漂白性
②若装置e中有40 mL 2.5 molL-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
(3)该小组的甲、乙两位同学利用下图装置继续探究SO2及氯气漂白性:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,用离子方程式表示品红溶液不褪色的原因是: 。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?