题目内容
【题目】某兴趣小组同学欲研究SO2的相关性质。
(1)比较下表中的两组物质关系,第2组中物质X的化学式是 。
第1组 | 第2组 |
C、CO、CO2、H2CO3、Na2CO3、、NaHCO3、 | S 、SO2、SO3、X、Na2SO4、NaHSO4 |
(2)利用下图装置来检验SO2的性质
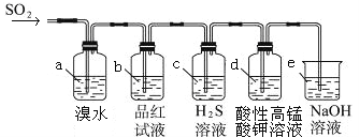
①装置a中的现象是: ; (填“能”或“不能”)说明SO2有漂白性
②若装置e中有40 mL 2.5 molL-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
(3)该小组的甲、乙两位同学利用下图装置继续探究SO2及氯气漂白性:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,用离子方程式表示品红溶液不褪色的原因是: 。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
【答案】
(1)H2SO4
(2)①溴水褪色,不能;②3SO2+4NaOH==Na2SO3+2NaHSO3+H2O
(3)①SO2+Cl2+2H2O=SO42-+2Cl—+4H+
②控制SO2和Cl2进气的物质的量,使之不相等
【解析】
试题分析:(1)第一组中碳元素的化合价依次升高,最后变成酸、正盐、酸式盐、依次低组中硫元素的化合价升高到+6价,故X为硫酸,故答案为:H2SO4;
(2)①二氧化硫具有还原性,溴水具有氧化性,发生氧化还原反应,溴水褪色,不能说明 SO2有漂白性,故答案为:溴水褪色,不能;
②若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH═Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH═NaHSO3;装置Ⅳ中有40mL 2.5molL-1 NaOH溶液中n(NaOH)=0.1mol,n(SO2)=![]() =0.075mol;n(SO2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠;设生成亚硫酸钠xmol、亚硫酸氢钠ymol,则:x+y=0.075,2x+y=0.1,解得:x=0.025,y=0.05,即n(Na2SO3):n(NaHSO3)=1:2,所以反应的化学方程式为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O,故答案为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O;
=0.075mol;n(SO2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠;设生成亚硫酸钠xmol、亚硫酸氢钠ymol,则:x+y=0.075,2x+y=0.1,解得:x=0.025,y=0.05,即n(Na2SO3):n(NaHSO3)=1:2,所以反应的化学方程式为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O,故答案为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O;
(3)①氯气和二氧化硫在水溶液中恰好完全反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;②当通入的二氧化硫或者氯气一方有剩余时,有具有漂白性,使品红褪色,故答案为:控制SO2和Cl2进气的物质的量,使之不相等。


