题目内容
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
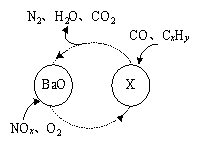
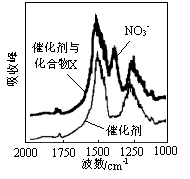
图1 图2
①在图示的转化中,被还原的元素是 ,X的化学式为 。
②氮元素在周期表中的位置是 。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式: 。已知NOx与NH3的反应△H<0,为提高氮氧化物的转化率可采取的措施是 (任写一条)。
(3)利用ClO2 氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的化学方程式是2NO + ClO2 + H2O == NO2 + HNO3 + 2HCl,反应Ⅱ的离子方程式是 。
(4)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_________________。
②检验废水中是否存在NH4+的方法是 。
③若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为2 mol·L-1的次氯酸钠的体积为 mL。
【答案】(1)①N、O (2分) Ba(NO3)2 (1分) ②第二周期第ⅤA族(1分)
(2)16NH3+12NO+6NO2=17N2+24H2O(2分) 增大NH3浓度(降低温度)(1分)
(3)2NO2+4SO32-=N2+4SO42-(2分) (4)①![]() (1分)
(1分)
②取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成NH4+(2分) ③30(2分)
【解析】
试题分析:(1)①根据图示可知,在图示的转化中,NOx中的N元素的化合价部分降低,O2中的O元素的化合价降低,得到电子,被还原;所以被还原的元素是N、O;其中的部分NOx中的N元素的化合价部分升高,变为HNO3,与BaO发生反应,形成Ba(NO3)2,所以形成的X的化学式为Ba(NO3)2;②氮元素在周期表中的位置是第二周期第ⅤA族;
(2)SCR技术可使NOx与NH3的直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,根据电子守恒、原子守恒,可得发生反应的化学方程式是16NH3 + 12NO + 6NO2 = 17N2 + 24H2O;已知NOx与NH3的反应△H<0,所以为提高氮氧化物的转化率可采取的措施是增大NH3浓度(降低温度);
(3)NO2氧化亚硫酸钠的离子方程式为2NO2 + 4SO32- = N2 + 4SO42- ;
(4)①次氯酸钠是离子化合物,的电子式为![]() 。
。
②氨气是碱性气体,则检验铵根的方法是:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成NH4+。
③若处理废水产生了0.448 L N2(标准状况),反应中转移电子的物质的量是![]() =0.12mol。氯元素的化合价从+1价降低到-1价,得到2个电子,所以根据电子得失守恒可知需要0.06mol次氯酸钠,溶液的体积为0.06mol÷2mol·L-1=0.03L=30mL。
=0.12mol。氯元素的化合价从+1价降低到-1价,得到2个电子,所以根据电子得失守恒可知需要0.06mol次氯酸钠,溶液的体积为0.06mol÷2mol·L-1=0.03L=30mL。