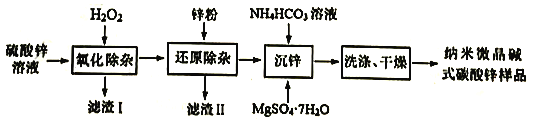
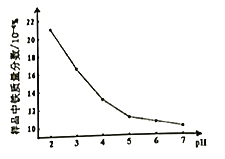
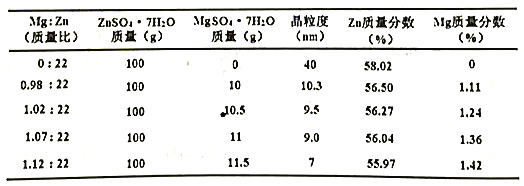
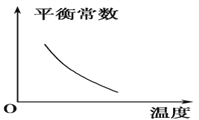
题目内容
【题目】下列对反应现象的描述错误的是( )
A. 浓硫酸加入到蔗糖中,蔗糖变黑并体积膨胀。
B. 将铜丝伸入浓硝酸中,产生红棕色气体
C. 将二氧化硫通入品红溶液中,溶液褪色
D. 氢气在氯气中燃烧,产生淡蓝色火焰
【答案】D
【解析】
A.浓硫酸加入到蔗糖中,蔗糖变黑体现了浓硫酸脱水性,体积膨胀体现了浓硫酸的强氧化性,A正确;
B.将铜丝伸入浓硝酸中,Cu与浓硫酸发生氧化还原反应,浓硝酸被还原产生红棕色NO2气体,B正确;
C.SO2具有漂白性,可以使品红溶液褪色,C正确;
D.氢气在氯气中燃烧,产生苍白色火焰,D错误;
故合理选项是D。

 阶梯计算系列答案
阶梯计算系列答案【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g)![]() 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为______________。
(2)300 ℃时,2NOCl(g) ![]() 2NO(g)+Cl2(g)。
2NO(g)+Cl2(g)。
正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=____________,k=______________。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:

①反应开始到10 min时NO的平均反应速率v(NO)=_________________ mol·L-1·min-1。
②T2时该反应的平衡常数K为_______________________。
③Cl2的平衡转化率为____________________________。
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件(温度、压强、 、与催化剂的接触面积),NO的转化率变化关系如图B所示。X代表_______________________。
、与催化剂的接触面积),NO的转化率变化关系如图B所示。X代表_______________________。