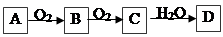题目内容
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。
下表列出了①~⑩十种元素在周期表中的位置:
请回答下列问题:
(1)十种元素中化学性质最不活泼的是 (填元素符号);
(2) 在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式);
(3) 元素①、②、⑤按原子半径由大到小的顺序依次为 (填元素符号),
原因 ;
(4) 元素⑥的氢化物的化学式为 ,其水溶液呈_____性(填“酸”、“碱”或“中”);
(5) 灼烧元素②与元素⑧形成的化合物,火焰呈 色;
(6)十种元素中 (填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为 。
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | | | | | | | ⑩ |
| 2 | | | | | ⑥ | | ⑦ | |
| 3 | ② | ③ | ④ | | | | ⑧ | |
| 4 | ⑤ | | | | | | ⑨ | |
(1)十种元素中化学性质最不活泼的是 (填元素符号);
(2) 在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式);
(3) 元素①、②、⑤按原子半径由大到小的顺序依次为 (填元素符号),
原因 ;
(4) 元素⑥的氢化物的化学式为 ,其水溶液呈_____性(填“酸”、“碱”或“中”);
(5) 灼烧元素②与元素⑧形成的化合物,火焰呈 色;
(6)十种元素中 (填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为 。
(1) He
(2) NaOH
(3) K>Na>H 处于同一主族,同一主族从上到下原子半径逐渐增大
(4) NH3 碱
(5) 黄
(6) Al 2Al+2OH-+2H2O===2AlO2-+3H2↑
试题分析:(1)最不活泼的元素找稀有气体元素,就是⑩,He;(2)②、③、④三种元素的氧化物对应的水化物为金属元素最高价氧化物对应的水化物,则金属性最强的,碱性就最强,所以为NaOH。(3)比较原子半径时,同主族元素从上到下原子半径逐渐增大。(4)⑥为第二周期,ⅤA族,则为氮元素,氢化物为氨气,水溶液呈碱性。(5)②为第三周期ⅠA族,为钠元素,⑧号为氯元素,则化合物为氯化钠,焰色反应为黄色。(6)既可以与酸反应又可以与碱反应的单质只有铝。
点评:本题需要根据元素所处的位置把元素推断出来,然后根据元素周期律中位、构、性的关系,利用元素周期律来解题。本题属于常规题型,学生对于此类题目应该熟练掌握。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
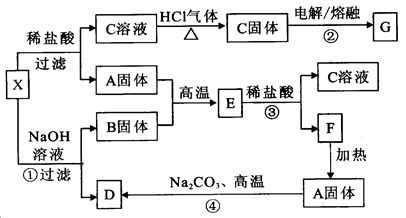
 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是