题目内容
【题目】氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g)+ 3H2(g)![]() 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。

(3)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是_____________。
②用NaClO溶液也可将废水中的NH4+ 转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液 L。
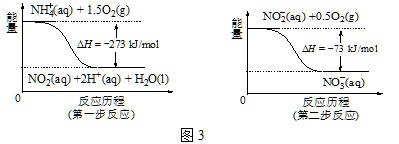
③在微生物的作用下,NH4+ 经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+ (aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
④用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
【答案】(1)△H <0,N2+6H++6e—=2NH3;(2)2,0.36; (3)① NaClO+2NH3═N2H4+NaCl+H2O;②0.3;③346 ;④升高。
【解析】
试题分析:(1)根据△G=△H-T△S,此反应是△S<0,自发进行△G<0,因此△H<0,根据H+移动方向,左端是正极,右端是负极,根据示意图,正极反应式为N2+6H++6e-=2NH3;(2)根据图像,c代表平衡体系中尿素的体积分数变化,因此比值为2时,尿素的产量最大,氨碳比=2,总物质量为3mol,则n(NH3)=2mol,n(CO2)=1mol,生成CO(NH2)2和水蒸气的物质的量为1×0.8mol=0.8mol,此时n(NH3) = (2-2 × 0.8) mol = 0.4 mol,n(CO2) = (1-1 ×0.8) mol = 0.2 mol,因此尿素的体积分数是0.8/(0.4 + 0.2 + 0.8 + 0.8) × 100% = 36%;(3)①NaClO作氧化剂,化合价由+1价→-1价,化合价降低2价,NH3作还原剂,NH3中-3价→-2价,化合价升高1价,最小公倍数是2,因此反应方程式为:NaClO+2NH3═N2H4+NaCl+H2O;②根据得失电子数目守恒,即V(NaClO)×0.3×2=0.672×2×3/22.4,解得V(NaClO)=0.3L;③第一步反应式为①NH4+(aq)+1.5O2(g) =NO2-(aq) +2H+(aq) +H2O(l) △H=-273 kJ·mol-1;②NO2-(aq) + 0.5O2(g) = NO3-(aq) △H=-73 kJ·mol-1,①+②得到NH4+(aq) + 2O2(g) = NO3-(aq) + H+(aq) + H2O(l) △H=-360 kJ·mol-1;④参加大于循环,即NO3-转化成N2,反应方程式为5H2 + 2NO3- = N2↑ + 2OH- + 4H2O,因此pH升高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
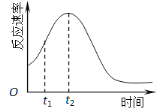 (5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
① ;② 。
