题目内容
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
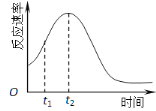 (5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
① ;② 。
【答案】(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)浓度;①<②;(3)0.0056;
(4)KMnO4,溶液完全褪色所需时间或产生相同体积气体所需的时间;
(5)①该反应放热;②产物Mn2+是反应的催化剂。
【解析】
试题分析:(1)高锰酸钾溶液的强氧化性,把草酸氧化成CO2,根据化合价升降法进行配平,其离子反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;(2)对比表格数据,草酸的浓度不一样,因此是浓度对化学反应速率的影响,浓度越大,反应速率越快,①<②;(3)根据反应方程式,求出消耗的n(KMnO4)=2.24×10-3×2/(22.4×10)mol=2×10-5mol,剩余n(KMnO4)=(30×10-3×0.01-2×10-5)mol=2.8×10-4mol,c(KMnO4)=2.8×10-4/50×10-3mol·L-1=0.0056mol·L-1;(4) KMnO4,溶液完全褪色所需时间或产生相同体积气体所需的时间;(6)①此反应是放热反应,温度升高,虽然反应物的浓度降低,但温度起决定作用;②可能产生的Mn2+是反应的催化剂,加快反应速率。