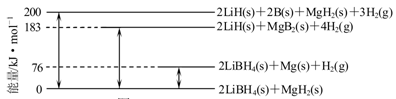
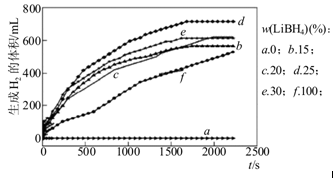
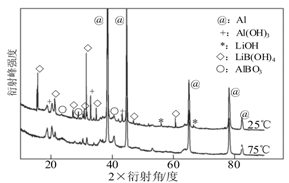
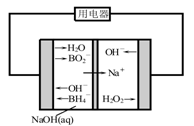
题目内容
“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO。
(1)Ca的原子结构示意图为 。其最高价氧化物对应水化物的碱性比Mg(OH)2 (填“强”或“弱”)。
(2)Ca与非金属性最强的元素A形成化合物D,用电子式表示D的形成过程: 。
(3)配平用“金属钙线”脱氧脱磷的方程式:
(4)将“金属钙线”溶于稀盐酸后,滴加少量双氧水后再滴加KSCN溶液呈红色,金属M为 (填化学式), 其中滴加双氧水发生的离子方程式是 。
(5)取3.2 g“金属钙线”试样,与水充分反应生成448 mL H2(标准状况),在所得溶液中通入适量CO2,最多能得到CaCO3 g。
(1)Ca的原子结构示意图 ; 强
; 强
(2)CaF2的形成过程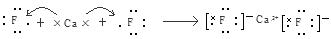 ;
;
(3)2,5,3,1,5
(4)Fe ; 2Fe2++ H2O2 + 2H+= 2Fe3+ + 2H2O
(5)2.2g ;
解析试题分析:(1)20号元素的原子核外电子排布为2、8、8、2.所以其结构示意图为 。Ca、Mg是同一主族的元素,从上到下元素的金属性逐渐增强,所以金属性:Ca>Mg。元素的金属性越强,其最高价氧化物对应的水化物的碱性越强。因此碱性Ca(OH)2>Mg(OH)2。(2)金属性很强的元素Ca与非金属性最强的元素F形成化合物CaF2是离子化合物。其形成过程用电子式表示为:
。Ca、Mg是同一主族的元素,从上到下元素的金属性逐渐增强,所以金属性:Ca>Mg。元素的金属性越强,其最高价氧化物对应的水化物的碱性越强。因此碱性Ca(OH)2>Mg(OH)2。(2)金属性很强的元素Ca与非金属性最强的元素F形成化合物CaF2是离子化合物。其形成过程用电子式表示为: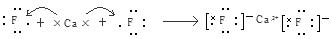 (3)在氧化还原反应中化合价升高与降低的总数相等。该反应的方程式为2P+5FeO+3CaO
(3)在氧化还原反应中化合价升高与降低的总数相等。该反应的方程式为2P+5FeO+3CaO 1Ca3(PO4)2+5Fe。(4)将“金属钙线”溶于稀盐酸后,滴加少量双氧水后再滴加KSCN溶液呈红色,金属M为Fe。 在该 中发生的反应为:FeO+2HCl= FeCl2+H2O;当向其中滴加双氧水时,发生氧化还原反应,在氧化还原反应中化合价升高与降低的总数相等。因此该反应的离子方程式是2Fe2+ + H2O2 + 2H+= 2Fe3+ + 2 H2O。(5)“金属钙线”试样,与水充分反应生成448 mL H2。因为只有Ca可以与水发生反应产生氢气:Ca+2H2O=Ca(OH)2+ H2↑。n(H2)=" 0.448L" ÷22.4L/mol="0.02mol.n(CaO)=" (3.2 g×3.5%)÷56g/mol=0.002mol.所以一共产生的Ca(OH)2的物质的量为:n(Ca(OH)2)=0.022mol.在所得溶液中通入适量CO2,发生反应:CO2+Ca(OH)2=CaCO3↓+H2O所以得到的CaCO3质量最多为0.022mol×100g/mol=2.2g。
1Ca3(PO4)2+5Fe。(4)将“金属钙线”溶于稀盐酸后,滴加少量双氧水后再滴加KSCN溶液呈红色,金属M为Fe。 在该 中发生的反应为:FeO+2HCl= FeCl2+H2O;当向其中滴加双氧水时,发生氧化还原反应,在氧化还原反应中化合价升高与降低的总数相等。因此该反应的离子方程式是2Fe2+ + H2O2 + 2H+= 2Fe3+ + 2 H2O。(5)“金属钙线”试样,与水充分反应生成448 mL H2。因为只有Ca可以与水发生反应产生氢气:Ca+2H2O=Ca(OH)2+ H2↑。n(H2)=" 0.448L" ÷22.4L/mol="0.02mol.n(CaO)=" (3.2 g×3.5%)÷56g/mol=0.002mol.所以一共产生的Ca(OH)2的物质的量为:n(Ca(OH)2)=0.022mol.在所得溶液中通入适量CO2,发生反应:CO2+Ca(OH)2=CaCO3↓+H2O所以得到的CaCO3质量最多为0.022mol×100g/mol=2.2g。
考点:考查元素的推断、原子结构示意图、离子化合物的电子式表示、元素的金属性强弱的比较、氧化还原反应方程式的配平、Fe3+离子的检验、离子方程式的书写及有关化学计算的知识。

(12分)某研究性学习小组在网上搜集到信息:钾、钙、钠、镁等活泼金属能在CO2气体中燃烧。他们对钠在CO2气体中燃烧进行了下列实验:
| 操作过程 | 实验现象 |
| 将干燥的玻璃燃烧匙中燃烧的钠迅速 伸入到盛有装满CO2的集气瓶中 | 钠在盛有CO2的集气瓶中继续燃烧 |
| 反应后冷却 | 集气瓶底附着黑色颗粒,瓶壁上附着有白色 物质 |
a.水 b.泡沫灭火剂 c.干沙土 d.二氧化碳
(2)该小组同学对瓶壁上的白色物质的成分进行讨论并提出假设
I.白色物质是Na2O;
II.白色物质是Na2CO3;
III.白色物质还可能是
(3)
| 实验步骤 | 实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全 部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
②写出该反应的方程式 。
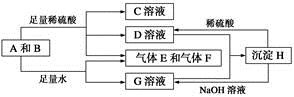
下面是有关物质的转化关系图(有些物质已省略)。
若A为单质,E在常温下为液体,C的相对分子质量为78。请回答下列问题: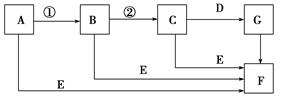
(1)画出A的原子结构示意图________,F的电子式是________。
(2)下面对C物质结构、性质的推断中,不正确的是________。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键和共价键 |
| D.遇湿润的紫色石蕊试纸只能使其变蓝色 |