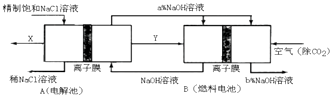
��Ŀ����
����Ŀ���������������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ����Ӧ�õ��������߿Ƽ�����
��1����֪�����ڽ���Ԫ��A��B���䵥�ʵ�λ������ȼ���ȴ�����ȼ�ϣ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
A | 899.5 | 1757.1 | 14848.7 | 21006.6 |
B | 738 | 1451 | 7733 | 10540 |
�ٸ����������ݷ�����B�����ڱ���λ�����������ӦΪ��
����ijͬѧ��Bԭ�ӵĻ�̬��Χ�����Ų�ʽд����ns1np1 �� Υ����ԭ����
��BԪ�صĵ�һ�����ܴ���Al��ԭ������
��2��������Ϊһ�������Դ�����������Ĵ������⣬C60������������ϣ�����֪���ʯ�е�C��C�ļ���Ϊ154.45pm��C60��C��C����Ϊ145��140pm����ͬѧ�ݴ���ΪC60���۵���ڽ��ʯ������Ϊ�Ƿ���ȷ���������� ��
��C60������ÿ��̼ԭ��ֻ�����ڵ�3��̼ԭ���γɹ��ۼ�����ÿ��̼ԭ������㶼����8��������ȶ��ṹ����C60�����ЦҼ���м�����Ŀ֮��Ϊ ��
���𰸡�
��1��s��+2�ۣ�������ͣ�þԭ��3s���ȫ�����������ϵ�
��2������ȷ��C60�Ƿ��Ӿ��壬�ۻ�ʱ�����ƻ���ѧ����3��1
���������⣺��1������A��B��ԭ�ӵĵڶ�����������֮�䶼��1��ͻԾ��˵���������ڢ�A�壬�����Ƕ��Ƕ�����Ԫ�أ���A�ĵ�һ�����ܱ�B�����AΪBeԪ�أ�BΪMgԪ�أ���MgԪ��������s����3S2 �� Ϊs��Ԫ�أ������2�����ӣ���+2�ۣ��ʴ�Ϊ��s��+2�ۣ�����Bԭ�ӵĻ�̬��Χ�����Ų�ʽд����ns1np1 �� ��֪��3s�ܼ�δ���������3p�ܼ���3s�ܼ�������3p�ܼ��ͣ�����Υ���������ԭ�����ʴ�Ϊ���������ԭ��������ΪMg�ļ۵����Ų�ʽ��3s2 �� 3S���ȫ�����������ϵͣ���Al��3s23p1 �� ���Ե�һ�����ܣ�Mg��Al���ʴ�Ϊ��þԭ��3S���ȫ�����������ϵͣ���2������ΪC60���ɵľ����Ƿ��Ӿ��壬Ӱ����Ӿ����۵�������Ƿ��Ӽ��������������ʯ���ɵľ�����ԭ�Ӿ��壬Ӱ��ԭ�Ӿ����۵��������ԭ�Ӽ乲�ۼ������ۼ����ô������Ӽ�����������˽��ʯ���۵����C60 �� ���Ծ���C60��C��C���ļ��ܿ��ܴ��ڽ��ʯ�������ۻ�ʱ�����ƻ���ѧ������˱Ƚϼ���û�����壬�ʴ𰸣�����ȷ��C60�Ƿ��Ӿ��壬�ۻ�ʱ�����ƻ���ѧ���� ��C60������ÿ��ԭ��ֻ�����ڵ�3��ԭ���γɹ��ۼ�����ÿ��ԭ������㶼����8�����ȶ��ṹ����ÿ��C�γɵ���3�����У���Ȼ��1��˫��������ÿ��Cԭ������������8�����ȶ��ṹ��˫����Ӧ����Cԭ������һ�룬��˫������1���Ҽ���1���м�����Ȼ�м���ĿΪ30��һ��C�����ߵ�3��C�γɹ��ۼ���ÿ�����ۼ�ֻ��һ���������Cԭ�ӣ����ԦҼ�Ϊ ![]() +30=90����C60�����ЦҼ���м�����Ŀ֮��Ϊ90��30=3��1���ʴ�Ϊ��3��1�� ��1������A��B��ԭ�ӵĵڶ�����������֮�䶼��1��ͻԾ�����Ƕ��Ƕ�����Ԫ����֪Ԫ��A��Ԫ��B���ٸ���Ԫ��ԭ�ӵ���Χ�����Ų����������ɽ�Ԫ�����ڱ��ֳ��������s����p����d����ds����f����BΪMgԪ�������ڱ���λ��S���������ӦΪ+2�ۣ����ɻ�̬��Χ�����Ų�ʽ��֪��3s�ܼ�δ���������3p�ܼ�����3s�ܼ�������3p�ܼ��ͣ���ͬ���ڴ����ҵ�һ����������IIA��IIIA��������2���ٸ��ݷ��Ӿ�����۵��빲�ۼ��ļ����ط�������C60������ÿ��ԭ��ֻ�����ڵ�3��ԭ���γɹ��ۼ�����ÿ��ԭ������㶼����8�����ȶ��ṹ����ÿ��C�γɵ���3�����У���Ȼ��1��˫��������ÿ��Cԭ������������8�����ȶ��ṹ��˫����Ӧ����Cԭ������һ�룬����Ϊ�Ҽ���˫������1���Ҽ���1���м���
+30=90����C60�����ЦҼ���м�����Ŀ֮��Ϊ90��30=3��1���ʴ�Ϊ��3��1�� ��1������A��B��ԭ�ӵĵڶ�����������֮�䶼��1��ͻԾ�����Ƕ��Ƕ�����Ԫ����֪Ԫ��A��Ԫ��B���ٸ���Ԫ��ԭ�ӵ���Χ�����Ų����������ɽ�Ԫ�����ڱ��ֳ��������s����p����d����ds����f����BΪMgԪ�������ڱ���λ��S���������ӦΪ+2�ۣ����ɻ�̬��Χ�����Ų�ʽ��֪��3s�ܼ�δ���������3p�ܼ�����3s�ܼ�������3p�ܼ��ͣ���ͬ���ڴ����ҵ�һ����������IIA��IIIA��������2���ٸ��ݷ��Ӿ�����۵��빲�ۼ��ļ����ط�������C60������ÿ��ԭ��ֻ�����ڵ�3��ԭ���γɹ��ۼ�����ÿ��ԭ������㶼����8�����ȶ��ṹ����ÿ��C�γɵ���3�����У���Ȼ��1��˫��������ÿ��Cԭ������������8�����ȶ��ṹ��˫����Ӧ����Cԭ������һ�룬����Ϊ�Ҽ���˫������1���Ҽ���1���м���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�