题目内容
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质.当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用.
(1)NaN3是气体发生剂,受热分解产生N2和Na,NaN3中N3﹣中心原子采用杂化.
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为(已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,KClO4含有化学键的类型为 , K的原子结构示意图为 .
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 .
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况).
①用碱石灰除去的物质为;
②该产气药剂中NaN3的质量分数为 .
【答案】
(1)sp
(2)Fe
(3)离子键、共价键;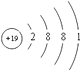
(4)2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)CO2、H2O;65%
【解析】解:(1)N3﹣与二氧化碳是等电子体,所以中心原子采用sp杂化,所以答案是:sp;(2)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe,
所以答案是:Fe;(3)KClO4由钾离子与高氯酸根离子构成,高氯酸根离子中Cl原子与O原子之间形成共价键,含有离子键、共价键,K原子质子数为19,原子核外有4个电子层,各层电子数为2、8、8、1,原子结构示意图为 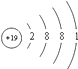 ,所以答案是:离子键、共价键;
,所以答案是:离子键、共价键;  ;(4)碳酸氢钠分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3
;(4)碳酸氢钠分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,
Na2CO3+CO2↑+H2O,
所以答案是:2NaHCO3 ![]() Na2CO3+CO2↑+H2O;2NaHCO3=Na2CO3+CO2↑+H2O(5)①碱石灰可以吸收二氧化碳、水蒸汽,用碱石灰除去的物质为CO2、H2O,所以答案是:CO2、H2O;
Na2CO3+CO2↑+H2O;2NaHCO3=Na2CO3+CO2↑+H2O(5)①碱石灰可以吸收二氧化碳、水蒸汽,用碱石灰除去的物质为CO2、H2O,所以答案是:CO2、H2O;
②氮气的物质的量 ![]() =1.5mol,根据氮元素守恒n(NaN3)=
=1.5mol,根据氮元素守恒n(NaN3)= ![]() =1mol,则m(NaN3)=1mol×65g/mol=65g,故NaN3的质量分数为
=1mol,则m(NaN3)=1mol×65g/mol=65g,故NaN3的质量分数为 ![]() ×100%=65%,
×100%=65%,
所以答案是:65%.

 阅读快车系列答案
阅读快车系列答案【题目】下列实验现象描述正确的是
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D