题目内容
【题目】人类的生产生活离不开金属材料,金属及金属材料在生产、生活中应用广泛.
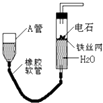
(1)生活中常用的铁锅炒菜,主要是利用了铁的;铁在潮湿的空气中容易锈蚀,喷漆可以延缓汽车钢铁外壳的锈蚀,起防锈原理是隔绝 , 喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,写出其中涉及到的一个化学方程式: .
(2)化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程: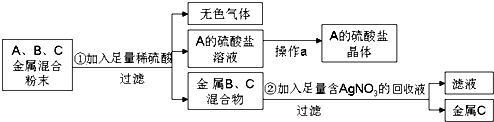
①A、B、C三种金属的活动性顺序为 .
②金属C是 , 已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: .
【答案】
(1)导热性;氧气和水;Fe2O3+6HCl=2FeCl3+3H2O
(2)A>B>C;Ag;Mn+H2SO4=MnSO4+H2↑
【解析】解:(1)生活中常用的铁锅炒菜,主要是利用了铁的良好的导热性;潮湿的空气中含义氧气、水,能够氧化铁而使铁发生腐蚀,汽车钢铁外壳喷漆隔绝氧气和水,减缓铁的腐蚀;氧化铁能与盐酸反应生成氯化铁和水,方程式:Fe2O3+6HCl=2FeCl3+3H2O;故答案为:导热性;氧气和水;Fe2O3+6HCl=2FeCl3+3H2O;(2)铜、银、锰(Mn)的混合粉末中只有A能与稀硫酸反应生成无色气体和A的盐溶液,所以我们判断A是Mn;金属B、C为铜和银;B、C的混合物加入足量的含硝酸银溶液中,过滤后得到金属C,说明金属C不能与硝酸银溶液反应,金属B能与硝酸银溶液反应,B是Cu,C是银,①依据活泼性强的金属能够置换活泼性弱的金属,所以:A、B、C三种金属的活动性顺序:A>B>C;故答案为:A>B>C;②步骤②的反应是铜和硝酸银反应生成硝酸铜和银,所以C是银;已知A的硫酸盐中A元素显+2价,硫酸根显﹣2价,又因为金属A我们已得知是Mn,所以A的硫酸盐的化学式是MnSO4,锰和硫酸反应生成硫酸锰和氢气,化学方程式为:Mn+H2SO4=MnSO4+H2↑;
故答案为:Ag;Mn+H2SO4=MnSO4+H2↑;
(1)铁具有良好的导热性;铁具有强的还原性,遇到氧气、水发生氧化还原反应而被腐蚀;氧化铁能与盐酸反应生成氯化铁和水;(2)根据金属活动性顺序判断金属是否与酸反应、金属是否能与盐溶液的反应.