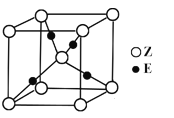
题目内容
【题目】实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说法正确的是( )
A.每生成1 mol N2转移的电子的物质的量为6 mol
B.N2既是氧化剂,又是还原剂
C.NH4Cl中的氮元素被还原
D.NaNO2是氧化剂
【答案】D
【解析】
试题分析:A、每生成1 mol N2转移的电子的物质的量为3 mol,错误;B、N2为生成物,既是氧化产物,又是还原产物,错误;C、NH4Cl中的氮元素的化合价由-3价升高到0价,被氧化,错误;D、NaNO2中N元素的化合价由+3价降低为0价,得电子,作氧化剂,正确。

 阅读快车系列答案
阅读快车系列答案【题目】.甲醇作为一种较好的可再生能源,具有广泛的应用前景。
已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) ![]() CH3OH(g) H1=-90kJ·mol-1
CH3OH(g) H1=-90kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g) + H2(g) H2=-41kJ·mol-1
CO2(g) + H2(g) H2=-41kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:___________________。
Ⅱ. 已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度 | ||
500℃ | 700℃ | 800℃ | ||
2H2(g) + CO(g) | K1 | 2.5 | 0.34 | 0.15 |
H2(g) + CO2(g) | K2 | 1 | 1.7 | 2.52 |
3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应①是__________(填“吸热”或“放热“)反应
(2)观察①②③可推导出K1、K2、K3之间的关系,则K3=_______(用K1、K2表示)
(3)某温度时,反应①式中各物质的平衡浓度符合下式:20×c(CH2OH)=3×c(CO)×c3(H2),试判断此时的温度为____________。
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4 mol· L-1、1 mol·L-1、0.5 mol·L-1、0.4 mol·L-1molL-1,则此时V(正)______V(逆)(填“>”、 “=”或“<”)。
(5)对应反应③,一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应,下列能说明该反应达平衡状态的有_____________。
A.体系密度保持不变
B.H2和CO2的体积比保持不变
C.混合气体的平均相对分子量不变时,反应一定达到平衡状态
D.当破坏CO2中2个碳氧双键,同时破坏H2O中的2个氧氢键,反应一定达到平衡状态