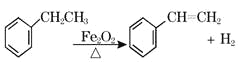
题目内容
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)一定条件下,H2 、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有________。
CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有________。
A.v(H2)=2v(CO)
B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量不随时间而变化
(2)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g) ![]() CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T )、压强(p)的关系如下图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T )、压强(p)的关系如下图1所示。
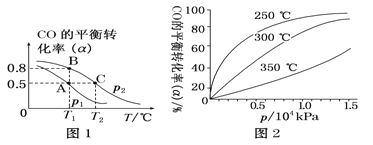
①合成甲醇的反应为________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为________,p1和p2的大小关系为______。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_______ L。
④ CO的平衡转化率(α)与温度(T )、压强(p)的关系如上图2所示,实际生产时条件控制在250 ℃ 、1.3×104 kPa左右,选择此压强的理由是_________________。
【答案】(1) B D
(2)① 放热 ② KA=KB>KC p1<p2 ③ 2
④ 在1.3×104 kPa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加
【解析】
试题分析:(1)A.v(H2)=2v(CO),没有正逆反应速率,不能说明反应达到平衡状态,错误;B.该反应过程中有能量变化,在绝热密闭容器中,若反应发生,容器中的温度发生变化,K也发生变化,当平衡常数K不再随时间而变化时,反应达到平衡状态,正确;C.在体积固定的密闭容器中,质量和体积始终保持不变,混合气体的密度始终保持不变,不能说明反应达到平衡状态,错误;D.该反应左右气体系数和不相等,根据M=m÷n,混合气体的平均相对分子质量不随时间而变化时说明反应达到平衡状态,正确;答案选BD。
(2)①根据图1,升高温度,CO的平衡转化率降低,说明平衡向逆反应方向移动,而升高温度,平衡向吸热反应方向移动,所以合成甲醇的反应为放热反应。
②由图1可知,A、B两点是等温点,而C点温度大于A、B点,该反应为放热反应,升高温度,化学平衡常数降低,所以A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC。从P1到P2,CO的平衡转化率增大,说明平衡向正反应方向移动,该反应的正反应为系数减小的反应,增大压强,平衡向系数减小的方向移动,所以p1<p2。
③密闭容器中充有10 mol CO和20 mol H2,若达到平衡状态A时,CO的转化率为50%,则平衡时CO为5mol,氢气为10mol,甲醇为5mol,总物质的量为20mol,在平衡状态B时,CO的转化率为80%,则平衡时CO为2mol,氢气为4mol,甲醇为8mol,总物质的量为14mol,A、B两点的温度相同,化学平衡常数不变,设容器的体积为V,则0.5÷(0.5×1)=8/V÷2/V×(4/V)2,解得V=2。
④在1.3×104 kPa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加,所以实际生产时条件控制在250 ℃ 、1.3×104 kPa左右。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】二氧化碳的回收利用是环保领域研究热点。
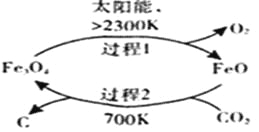
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比![]() 的关系如右图所示。
的关系如右图所示。
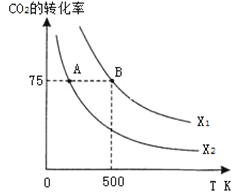
①平衡常数KA KB
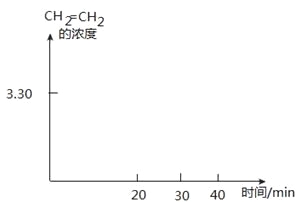
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0
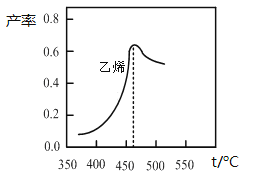
上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)