题目内容
铁棒和石墨棒用导线连接后,浸入0. 01mol/L 的氯化钠溶液中,下列说法正确的是
| A.铁棒附近产生OH— | B.铁棒质量减少 |
| C.石墨棒上放出氢气 | D.石墨棒上放出氧气 |
B
解析试题分析:属于原电池,先判断电极材料不能与电解质溶液反应,可知为吸氧腐蚀,A.OH—在石墨附近产生,错误;B.铁棒受腐蚀而质量减少,正确;C.石墨棒上没有氢气析出,错误;D.吸收氧气而不是放出,错误。
考点:原电池,金属腐蚀中的吸氧腐蚀,内电路及电极反应。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
铜、锌和硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
| A.①③ | B.①④ | C.②③ | D.②④ |
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为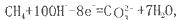 ,下列叙述正确的是
,下列叙述正确的是
| A.通入甲烷的一极为正极 |
| B.通入氧气的一极发生氧化反应 |
C.该电池总反应为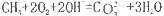 |
| D.该电池在工作时,溶液中的阴离子向正极移动 |
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是( )
| A.放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2 |
| B.放电时,正极区溶液的pH减小 |
| C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D.充电时,电池的锌电极接电源的正极 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.正极上发生的反应是:O2+4e-+2H2O=4OH- |
| B.该电池反应的化学方程式为:CH3CH2OH+3O2点燃2CO2+3H2O |
| C.检测时,电解质溶液中的H+向正极移动 |
| D.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是 
| A.Mg电极是该电池的正极 | B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH增大 | D.溶液中Cl-向正极移动 |
下图是一种燃料型电池检测仪的工作原理示意图。下列说法不正确的是 ( )
| A.该仪器工作时酒精浓度越大,则电流强度越大 |
| B.工作时处电路电子流向为X→Y |
| C.检测结束后,X极区的pH增大 |
| D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O |
人造地球卫星用的一种高能电池——银锌电池,该电池的电极反应式为:
Zn+2OH- -2e- = ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是( )
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是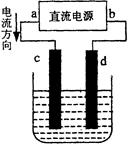
| A.a为负极、b为正极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |